Боль. Особенности лечения болевых синдромов
Содержание страницы
1. Мигрень
В терапии мигрени можно выделить три задачи: предотвращение приступов, их лечение и профилактика.
- Предотвращение приступов мигрени. Научив пациента выявлять предвестники, идентифицировать триггеры мигрени и избегать ситуаций, провоцирующих мигрень, можно добиться предотвращения или значительного снижения количества приступов без применения лекарств.
- Лечение приступов. Многих пациентов, страдающих мигренью, дезадаптирует страх, связанный с ожиданием приступа. В связи с этим очень важно проработать вместе с пациентом тактику лечения при различных сценариях развития мигрени.
- Профилактическое лечение мигрени. Если приступы мигрени частые (более 2 раз в неделю) и/или если поведенческие и фармакологические мероприятия малоэффективны, необходимо поставить вопрос о профилактическом лечении. Показаниями для этого также являются некоторые особые формы мигрени: гемиплегическая или с аурой с устойчивым неврологическим дефицитом.
Предотвращение приступов. Успех лечения во многом зависит от умения врача научить пациента распознавать триггеры и избегать ситуаций, провоцирующих мигрень. По данным нашего исследования, при первом рассказе связь наступления головной боли с какими-либо факторами отмечают около 30% пациентов, обращающихся к врачу (Данилов А.Б., 2007). При тщательном расспросе с помощью специальной анкеты, в которой перечислены все возможные триггеры головной боли, частота выявления таких факторов повышается до 85%. Сложность обнаружения провоцирующих факторов может объясняться тем, что некоторые из них у части больных не вызывают мигренозный приступ никогда, у других же вызывают, но не всегда. Так, например, многие пациенты, чувствительные к алкоголю, замечают, что если они находятся в хорошем расположении духа, расслаблены, соблюдают низкоуглеводную диету, употребление умеренного количества белого вина не приводит к негативным последствиям. Если же эти пациенты напряжены и едят много сладкого, такое же вино может вызвать у них сильнейший приступ мигрени. Когда наличие триггеров мигрени неочевидно, целесообразно использование дневника головной боли, который помогает распознать факторы, провоцирующие развитие мигрени.
Лекарственная терапия
Лечение приступов легкой интенсивности. Пациенты данной группы редко обращаются к врачу, поскольку им помогают физические способы борьбы с болью (тепло, холод), многочисленные народные методы (капустный лист, корка лимона, очищенная от цедры, и др.). Из фармакологических средств при редких приступах невыраженной головной боли, как правило, эффективны простые анальгетики, парацетамол или препараты из группы НПВП: ибупрофен, напроксен, индометацин, диклофенак и др. Выбор препарата следует делать в зависимости от предпочтений пациента с учетом прошлого опыта использования лекарств и риска желудочно-кишечных осложнений. Лечение приступов умеренной интенсивности. При боли умеренной интенсивности показаны НПВП. Более эффективными являются комбинированные анальгетики, содержащие кодеин или кофеин. Эти препараты можно приобрести без рецепта. Многие пациенты, к сожалению, излишне увлекаются ими, считая, что необходимо соблюдать осторожность только при применении лекарств, выписанных по рецепту врача. Следует помнить, что безрецептурные лекарственные средства при их избыточном применении могут потерять эффективность, а иногда даже вызвать абузусную головную боль, т. е. головную боль, причиной которой является избыточный прием лекарственного препарата.
При выраженной дезадаптации пациентов с умеренной интенсивностью головной боли может быть целесообразным начать терапию с препарата триптанового ряда. Применение триптанов позволяет снизить количество препаратов, которые принимаются пациентами для симптоматического лечения мигрени, и предотвратить хронизацию головной боли.
Лечение приступов с высокой интенсивностью. При высокой интенсивности головной боли рекомендуется сразу назначать препарат из группы триптанов.
«Золотым стандартом» терапии мигрени является суматриптан. Эффективность и безопасность суматриптана изучались в 300 тыс. атак (более 60 тыс. пациентов) в клинических испытаниях и в 200 млн атак в клинической практике за 15 лет его применения. Удовлетворенность пациентов данным препаратом составляет 63% и значительно превышает удовлетворенность препаратами других классов, которые используются для купирования мигрени (Pascual J., 2007). Суматриптан более эффективен у пациентов с медленным нарастанием головной боли.
Элетриптан, наратриптан и золмитриптан относятся ко второму поколению триптанов и обладают большей селективностью действия по сравнению с суматриптаном, что обусловливает меньшее количество побочных эффектов и большую эффективность по некоторым показателям. Применение этих препаратов целесообразно, когда прием суматриптана оказывается неэффективным.
Разработаны следующие рекомендации по применению препаратов из группы триптанов для купирования приступа мигрени. После того как больной почувствовал, что у него развивается приступ мигрени выраженной или умеренной интенсивности, следует принять таблетку препарата (минимальная доза). Если через 2 часа боль проходит, пациент может возвращаться к обычной деятельности. Если же через 2 часа боль уменьшилась, но не прошла совсем, рекомендуется прием еще одной дозы (таблетки) препарата. В следующий раз сразу можно принять его двойную дозу (2 таблетки).
Если через 2 часа после приема не было никакого эффекта, препарат признается неэффективным. В таком случае следует поставить вопрос о его замене. Некоторые специалисты по головной боли предлагают испробовать лекарство 3 раза, прежде чем отказываться от него. Другие врачи считают, что при следующем приступе следует использовать новый препарат. Мы придерживаемся второй точки зрения, т. е. если лекарство было принято своевременно во время правильно распознанной мигренозной атаки, и через 2 часа интенсивность головной боли совершенно не изменилась, при следующем приступе следует использовать другой препарат (триптан другой группы). Заметим, что отмечается выраженная вариабельность эффективности лекарства, в том числе внутри триптанового ряда, в зависимости от индивидуальной чувствительности. Важно терпеливо подбирать из имеющегося арсенала то средство, которое будет эффективно у данного больного. В некоторых случаях целесообразно использование опиоидных анальгетиков. Сильные приступы головной боли часто сопровождаются выраженной тошнотой и рвотой. В этом случае целесообразно применение противорвотных средств: метоклопрамида, домперидона, хлорпромазина.
Некоторые специалисты рекомендуют применять противорвотное средство за 20 минут до приема НПВП или триптанового препарата. Если приступ сопровождается тошнотой, целесообразно использование назального спрея с триптаном. При очень тяжелых упорных приступах мигрени необходимо применение кортикостероидов (8–12 мг дексаметазона внутривенно или внутримышечно). Существуют другие медицинские способы купирования мигрени, например, лечение пиявками, инъекции новокаина в триггерные точки и др. Эти методы весьма эффективны в руках тех специалистов, которые их разработали или имеют большой опыт их применения. Можно приветствовать нетрадиционные подходы к лечению головной боли, если они эффективны, но нельзя рекомендовать их для массового применения без проведения доказательных исследований.
Профилактическая терапия. Назначение профилактического лечения – ответственная задача, требующая тщательного предварительного обсуждения с пациентом. Оно связано с побочными эффектами вследствие длительного приема лекарственных средств и требует терпения от врача и пациента. Однако отсутствие профилактического лечения может стать причиной злоупотребления анальгетиками и развития абузусной головной боли. Частые приступы мигрени могут привести к возникновению хронической мигрени, а также стать факторами риска сосудистого поражения мозга.
Для профилактики мигрени используются различные фармакологические средства, в том числе те, в рекомендациях к которым пока еще нет данного показания. Предпочтительна монотерапия, в сложных случаях допускается комбинированное лечение с учетом сопутствующих заболеваний. Антидепрессанты и антиконвульсанты, которые занимают лидирующую позицию по эффективности профилактического лечения, до сих пор не имеют этого показания в инструкциях по применению. Из антиконвульсантов наиболее эффективны вальпроаты и новый антиконвульсант топирамат. Клинические исследования показали, что топирамат эффективно предотвращает приступы мигрени, значительно снижая их частоту. Его эффект развивается довольно быстро – в течение первого месяца терапии. Происходит стойкое длительное снижение количества приступов без развития резистентности. По сравнению с другими антиконвульсантами топирамат обладает благоприятным профилем переносимости (Brandes J.L., 2004).
Антидепрессанты давно используются для лечения мигрени. Основанием для их применения являются сведения, накопленные при терапии хронической боли. Антидепрессанты уменьшают сопутствующие симптомы депрессии, которая либо исходно имеется у пациента, либо развивается в связи с частыми приступами мигрени. Антидепрессанты потенцируют действие анальгетиков и триптанов, а некоторые из них обладают самостоятельной антиноцицептивной (обезболивающей) активностью.
2. Боль в спине
Рекомендации по диагностике и лечению
Рекомендация 1. Врач должен тщательно и целенаправленно провести клинико-неврологическое обследование пациента так, чтобы отнести его болевой синдром к одной из трех основных категорий:
- неспецифическая боль в спине;
- боль в спине, ассоциированная с радикулопатией или стенозом спинномозгового канала;
- боль в спине, ассоциированная с другими специфическими процессами на спинальном уровне (рак, инфекция). Сбор анамнеза должен включать в себя оценку психосоциальных факторов риска, которые позволяют прогнозировать риск хронизации болевого синдрома.
Рекомендация 2. Врач не должен повседневно использовать нейровизуализацию и другие диагностические тесты для пациентов с неспецифической болью в спине.
Рекомендация 3. Врач должен применять нейровизуализацию и другие диагностические методы для пациентов, у которых имеет место серьезный или прогрессирующий неврологический дефицит, а также при подозрении на серьезную этиологию болевого синдрома, опираясь на данные анамнеза и физическое обследование.
Рекомендация 4. Врач должен обследовать пациентов с персистирующей болью в спине и признаками или симптомами радикулопатии (стеноза) позвоночного канала с помощью МРТ (предпочтительно) или КТ в тех случаях, когда они являются потенциальными кандидатами на оперативное лечение либо эпидуральную инъекцию стероидов (при подозрении на радикулопатию).
Рекомендация 5. Пациенту с установленным диагнозом врач должен предоставлять информацию, касающуюся ожидаемого курса лечения, советовать оставаться активным, предложить варианты эффективной самопомощи.
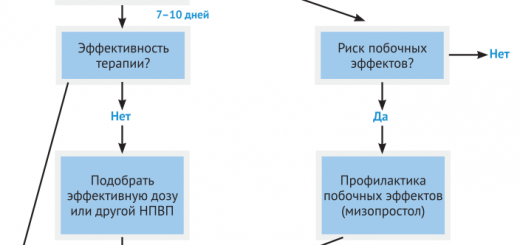
Рекомендация 6. Врач должен рассмотреть вопрос об использовании препаратов с доказанной эффективностью в сочетании с методами самопомощи. Перед началом терапии необходимо оценить выраженность болевого синдрома и функционального дефицита, потенциальную эффективность лекарства, риск побочных явлений. Для большинства пациентов препаратами первого выбора являются парацетамол и НПВП.
Неселективные НПВП более эффективны для облегчения боли, но высок риск при их применении желудочно-кишечных и реноваскулярных осложнений. Кроме того, существует связь между действием на организм ЦОГ-2-селективных НПВП (т. е. воздействующих на циклооксигеназу 2) и повышенным риском инфаркта миокарда. Перед назначением НПВП врач должен оценить факторы риска сердечно-сосудистых и желудочно-кишечных осложнений и рекомендовать минимальную эффективную дозу на необходимый максимально короткий срок приема. Врач должен сводить к минимуму риск возникновения осложнений от приема НПВП (например, совместный прием с ингибиторами протонной помпы). Для предотвращения желудочнокишечных осложнений наиболее безопасной является комбинация селективных ингибиторов ЦОГ-2 с ингибиторами протонной помпы. В настоящее время нет достаточных данных для рекомендации аспирина как анальгетика при боли в спине. Опиоидные анальгетики и трамадол при разумном использовании являются вариантом терапии у пациентов с интенсивной острой или хронической болью в спине, которая не купируется парацетамолом и НПВП. Преимущества и недостатки опиоидных анальгетиков должны быть тщательно взвешенны. При отсутствии эффекта от наркотических анальгетиков необходимо произвести повторную диагностику больного или найти альтернативный метод терапии. Нет достаточных оснований для смены одного опиоидного анальгетика на другой.
Для уменьшения боли, обусловленной мышечным напряжением, используются миорелаксанты. Наиболее эффективными являются тизанидин и толперизон. Миорелаксанты обеспечивают кратковременное уменьшение острой боли в спине, но оказывают побочное действие на ЦНС (в первую очередь это седация). ТЦА (амитриптилин) являются вариантом лечения хронической боли в спине при отсутствии противопоказаний к этим препаратам. Начинать следует с небольших доз (12,5 мг на ночь) с постепенным повышением при необходимости до 75 мг/ сут. Селективные ингибиторы обратного захвата серотонина (флуоксетин, пароксетин, сертралин, циталопрам) не показали эффекта при лечении боли в спине, поэтому не рекомендуются. Эффективность ингибиторов обратного захвата серотонина и норадреналина (венлафаксина и дулоксетина) при боли в спине пока не оценена. Следует подчеркнуть, что обезболивающий эффект упомянутых препаратов не зависит от их антидепрессивного эффекта и наступает раньше (через 10–14 дней).
При острой или хронической боли в спине бензодиазепины показали ту же эффективность, что и миорелаксанты (кратковременное улучшение). Однако следует иметь в виду риск злоупотребления и привыкания. При использовании бензодиазепинов рекомендованы ограниченные по времени курсы терапии, направленные на миорелаксацию, снижение повышенной тревожности и улучшение сна.
В последние годы опубликовано несколько исследований, посвященных изучению эффективности инъекционного препарата Алфлутоп при болях в спине. Так, у больных с хроническими алгическими вертеброгенными синдромами применение Алфлутопа по 1 мл в день №20 способствовало стойкому уменьшению боли, увеличению подвижности позвоночника и расширению функциональных возможностей пациентов. Лечебный эффект препарата Алфлутоп проявлялся уже в течение первых двух недель лечения и нарастал на протяжении всего курса проводимой терапии.
Применение внутрь стероидов при боли в спине не рекомендуется, т. к., по данным контролируемых исследований, они неэффективны.
Рекомендация 7. В случае отсутствия улучшения при применении больным различных видов самопомощи врач должен рассмотреть вопрос о добавлении нефармакологических методов терапии с доказанными эффектами. Для больных с острой болью в спине применяют методы мануальной терапии, для пациентов с подострой или хронической болью – ЛФК, акупунктуру, массаж, мануальную терапию, йогу, когнитивно-поведенческую терапию, междисциплинарную реабилитацию.
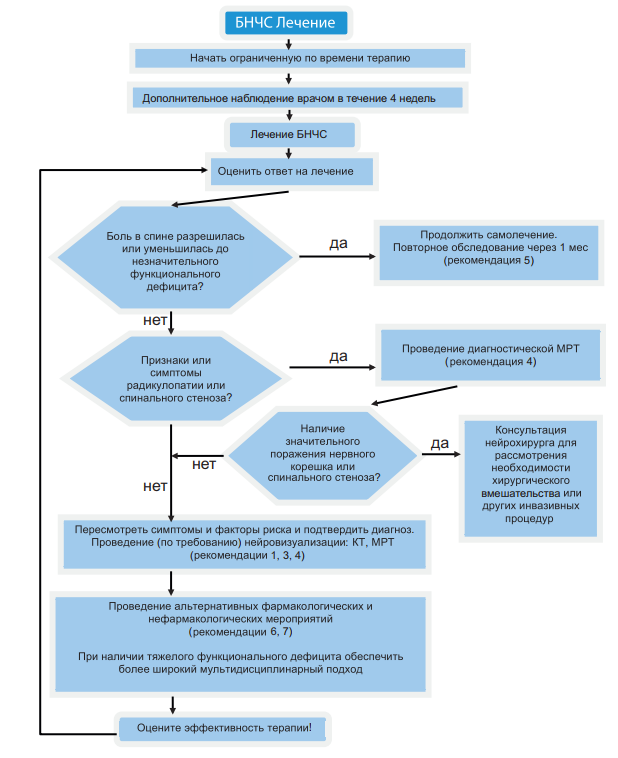
Алгоритм лечения боли в нижней части спины представлен на рисунке 17.
Рисунок 17. Лечение боли в нижней части спины
3. Кардиалгии
Среди разнообразных болевых синдромов, встречающихся в неврологической практике, кардиалгии занимают особое место. Как известно, из всех существующих у человека телесных ощущений «боль» является одним из самых распространенных. Понятие «сердце» для большинства людей является термином, обозначающим основной орган, обеспечивающий жизнь человека. В обыденной жизни в достаточной мере часто эти два представления соединяются в жалобах больных в виде феномена «боль в сердце». Часто выясняется, что различные ощущения (например, парестезии, чувство давления, сжатия и т. д.) обобщенно воспринимаются больными как «боль», а левая половина грудной клетки или грудины обозначается больными как «сердце». Для определения указанных феноменов в медицине существует несколько терминов: боли в области сердца – кардиалгии; боли в грудной клетке – торакалгии, при этом, разумеется, кардиалгии являются вариантом торакалгий.
Боль в области сердца может иметь различный генез, и в практической медицине различают несколько больших групп основных заболеваний, при которых встречаются кардиалгии:
- Кардиалгии, связанные с патологией сердца и крупных сосудов.
- Кардиалгии, обусловленные патологией органов грудной клетки и средостения.
- Кардиалгии в рамках психовегетативного синдрома.
- Кардиалгии вертеброгенного и миофасциального происхождения.
При этом важно отметить, что практически 90% всех кардиалгий обусловлены тремя основными причинами: ИБС, вертеброгенномышечной патологией и психовегетативными расстройствами (Donat W.E., 1987; Ho K., 1996; Anzai A.K., Merkin T.E., 1996). Этим определяется актуальность своевременной и правильной диагностики не только патологии коронарных артерий, но и широко распространенных, особенно в последние десятилетия, психовегетативных и вертеброгенных синдромов. Дифференциальная диагностика указанных состояний часто является достаточно сложной. Диагностические трудности иллюстрируют следующие примеры. Коронарография, проводимая больным с клинической картиной типичной стенокардии, выявляет нормальные коронарные артерии у 10–20% этих больных (Marshall J.B., 1992).
У пациентов с атипичной картиной стенокардии неизмененные коронарные артерии обнаруживают в 70% случаев (Richards S.D., 1992). Специальные исследования, проведенные у больных с жалобами на боль в области сердца с нормальными коронарными артериями, в 37–43% случаев выявили признаки панических (психовегетативных) расстройств (Beitman B.D. et al., 1989). В исследовании приняли участие более 7 тыс. больных, поступивших в отделение неотложной помощи с болью в области сердца. При первичном осмотре и ЭКГ только в 4% случаев был установлен инфаркт миокарда (ИМ), в 51% имелись подозрения на него, а у 41% диагноз ИМ был отвергнут. Доминировали боль мышечная и психогенная (Karlson B.W. et al., 1991). В некоторых исследованиях указывается, что у 80% амбулаторных больных кардиалгии носят психогенный характер (Katon W.J., 1990).
Лечение кардиалгий сводится к коррекции заболевания, которое вызвало боль в сердце. Основные принципы лечения кардиальной боли психогенной природы – проведение коррекции психической, вегетативной и соматической сфер с учетом специфики каждого конкретного синдрома и, естественно, индивидуальности пациента (Gutgesell H.P. et al., 1997; Olden K.W., 1998).
4. Абдоминалгии
Клиницистам в практической деятельности часто приходится сталкиваться со случаями возникновения абдоминальной боли, которая не связана с органическими заболеваниями ЖКТ или гинекологической сферой, но представляет определенные диагностические трудности. Боль в животе, не имеющая в своей основе органических изменений и носящая рекуррентный характер, встречается у 90–95% детей, страдающих нарушениями ЖКТ. Среди больных с психогенными нарушениями ЖКТ боль в животе как ведущее проявление встречается в 30% случаев. Психогенный характер хронической боли определяется у 40% пациентов с абдоминалгиями. В этом контексте можно привести данные большого эпидемиологического исследования острой боли в животе.
Было показано, что острая боль в животе является основной жалобой по крайней мере у одного из 20 больных, поступающих в отделение неотложной помощи. Интересно, что наиболее частым окончательным диагнозом в данном исследовании была «боль в животе неясной этиологии» (41,3%). Три других наиболее распространенных состояния также не требовали хирургического вмешательства: гастроэнтерит (6,7%), воспалительные заболевания органов таза (6,7%) и инфекции мочевого тракта (5,2%). Наиболее распространенная хирургическая патология – аппендицит встречался лишь в 4,3% случаев. По данным исследования, проведенного в Москве, около 1/3 оперативно удаленных отростков у больных с диагнозом «аппендицит» при последующем гистологическом исследовании оказались нормальными. Представленные результаты свидетельствуют о том, что у большинства больных острая боль в животе вызвана нехирургическими заболеваниями и что довольно часто четкий диагноз поставить не удается.
В последние годы все очевиднее становится тот факт, что психические факторы и вегетативная дисфункция играют важнейшую роль в патогенезе так называемых неорганических («функциональных») заболеваний ЖКТ. При этом существуют две ситуации, когда абдоминалгический синдром может быть главным или одним из ведущих проявлений болезни: это синдром раздраженного кишечника (СРК) и синдром желудочной диспепсии. Боль при этих синдромах принято относить к дисфункциональному типу. СРК – хроническое патологическое состояние, которое характеризуется наличием боли в животе, сочетающейся с расстройствами функции кишечника (понос, запор) без нарушения аппетита и снижения массы тела, с продолжительностью расстройств не менее 3 месяцев при отсутствии органических изменений ЖКТ, которые могли бы объяснить имеющиеся расстройства. Болевой синдром характеризуется многообразием проявлений: от диффузной тупой боли до острой, спазматической; от постоянной до пароксизмов боли в животе. Длительность болевых эпизодов – от нескольких минут до нескольких часов. В 90% случаев боль сопровождается дисфункцией кишечника (понос или запор).
Наиболее признанные критерии СРК:
- Наличие абдоминальной боли без органических изменений ЖКТ.
- Расстройства стула.
- Клинические проявления – постоянные или периодические, продолжающиеся более 3 месяцев.
- Отсутствие других заболеваний у пациента, которые могли бы объяснить генез имеющихся расстройств.
Данные, полученные в США и Великобритании, указывают на то, что распространенность СРК составляет 14–24% у женщин и 5–19% у мужчин. Наиболее часто эта патология встречается в возрасте от 30 до 50 лет, при этом к 60 годам ее распространенность снижается. Для заболевания характерно чередование ремиссии и обострений. До 70% страдающих СРК не обращаются в лечебные учреждения. По-видимому, на обращаемость влияют особенности культуры, тяжесть симптомов и психологические расстройства. Лишь небольшую часть пациентов, обращающихся за первичной медицинской помощью, направляют к гастроэнтерологам. Однако СРК является самым распространенным расстройством в гастроэнтерологической практике.
Этиология и патогенез СРК до сих пор не выяснены. Изменение психической сферы в виде тревожных и депрессивных расстройств встречается у 70–90% этих больных. В ряде исследований было обнаружено, что часто развитию симптомов предшествовали неблагоприятные события, включая сексуальное и эмоциональное насилие в молодости. Абдоминальная боль в детстве может оказаться предвестником СРК во взрослом возрасте. Пациенты, страдающие СРК, часто отмечают и другие симптомы и, консультируясь по этому поводу, не сообщают о симптомах со стороны кишечника. Довольно часто СРК сочетается с синдромом хронической усталости и фибромиалгией.
На наш взгляд, вполне допустимо рассматривать этот синдром как вариант надсегментарной вегетативной патологии в рамках синдрома вегетативной дистонии (психовегетативного синдрома), где основной заинтересованной системой оказывается ЖКТ. Несмотря на то, что специфического патофизиологического обоснования не выявлено, при СРК было обнаружено множество различных физиологических процессов, которые связаны с абдоминальной болью: патологическая моторика кишечника, повышенная чувствительность внутренних органов, вегетативная дисфункция и модуляция активности ЦНС. Взаимодействие периферических и центральных нервно-мышечных механизмов вступает в конфликт и явно взаимодействует с психологическими и поведенческими факторами, которые включают обострение симптомов при стрессе и вариации болевого поведения.
Диспепсия проявляется как боль в животе, дискомфорт или тошнота, которые появляются периодически, держатся не менее месяца, не связаны с физическими упражнениями и не исчезают в течение 5 мин отдыха. Болевой синдром при диспепсии во многом идентичен боли при СРК. Она, как правило, сочетается с ощущением тяжести, давления и переполнения после еды в эпигастральной области, сопровождается отрыжкой воздухом или пищей, неприятным металлическим вкусом во рту и иногда снижением аппетита. Пациентов, как правило, беспокоят также урчание, чувство переливания и усиление перистальтики. Чаще у больных развивается понос, реже запор. Однако надо отметить, что подобные расстройства, несмотря на то, что они беспокоят больных, причиняя многочисленные страдания, вызывая астенические и вегетативные расстройства, существенно не влияют на социальную активность пациентов.
Эффективное лечение СРК возможно только при применении мультимодального подхода, основанного на принципах биопсихосоциальной модели заболевания. Медикаментозное лечение СРК складывается из применения специфических гастроэнтерологических препаратов для контроля моторики кишечника (лоперамид и др.) и психотропных средств. Лечение антидепрессантами показано при ярко выраженных депрессивных расстройствах, но есть также доказательства, что они помогают облегчать боль при отсутствии выраженной психопатологии. Лучшие результаты получены при применении ТЦА и дулоксетина.
Лечение пациентов с СРК должно носить позитивный и успокаивающий характер. Следует предоставить разъяснения и дать рекомендации, отвечающие индивидуальным потребностям больных. Лечение проводится с использованием пошагового и многопрофильного подходов, представленных в обобщенном виде.
На первом этапе лечения очень важно, чтобы врач располагал достаточным временем для уменьшения обеспокоенности пациента. На этом этапе ограничиваются выяснением анамнеза и осмотром. Обсуждение и объяснение симптомов включают рассмотрение физиологических и психологических факторов с акцентом на том, что больной может сделать сам для облегчения боли и восстановления трудоспособности, активно следуя согласованной стратегии или выполняя упражнения. Важно, чтобы лечение было последовательным, при этом у пациента должна быть возможность повторно задать вопросы, если у него возникнут сомнения по поводу подхода к лечению. Имеет смысл подчеркнуть, что основные цели терапии – это улучшение функций и повышение трудоспособности, а не окончательное избавление от симптомов. Такое сочетание общих мер с медикаментозным лечением эффективно для большинства больных. Согласно клиническому опыту более чем у 70% пациентов с СРК при таком подходе наступало облегчение симптомов или же пациенты справлялись с ними лучше.
При более стойких нарушениях следует рассмотреть краткие стратегии психологического управления и уделить дополнительное внимание пониманию больными этих симптомов и особенно канцерофобии. Это особенно актуально, если есть возможность проконсультироваться с психиатром или психологом, которые имеют опыт работы с такими проблемами и могли бы дать рекомендации по использованию простых видов лечения, не требующих специальной подготовки.
Каждый из основных четырех видов психологического лечения – когнитивную терапию, поведенческую терапию, межличностную терапию и гипнотерапию – можно стандартизировать с помощью протоколов лечения (Blanchard, 2001). Чаще всего лечение проводится на индивидуальной основе раз в неделю в течение 8–16 недель.
5. Нейропатическая боль
Это боль, возникающая при поражении или заболевании соматосенсорной нервной системы на всех ее уровнях – от периферического нерва до коры больших полушарий. Частота встречаемости в популяции достигает 6–7%, а на неврологических приемах пациенты с нейропатической болью составляют 10–12%.
Этот тип болевого синдрома трудно лечить, и немногим пациентам удается полностью купировать болевой синдром. Как правило, у больных нарушается сон, развиваются депрессия и тревога, снижается качество жизни. Многие из них долго мучаются, прежде чем получают адекватную помощь. Большинство пациентов (около 80%) испытывают боль более года до своего первого обращения к специалисту. Лечение основного заболевания (что, естественно, является безусловным) не всегда приводит к редукции боли. Нередко мы наблюдаем диссоциацию между выраженностью боли и степенью поражения нервной системы. Увы, многие пациенты с нейропатической болью ошибочно принимают НПВП, которые при этом типе боли неэффективны. Это обусловлено тем, что при нейропатической боли главными патогенетическими механизмами являются не процессы воспаления и активации периферических ноцицепторов, а нейрональные и рецепторные нарушения, периферическая и центральная сенситизация.
Диагностика нейропатической боли нередко представляет для лечащих врачей сложную задачу. Трудности могут быть связаны с различными факторами, включая разноплановую клиническую картину и отсутствие четких диагностических критериев. Оценка нейропатической боли проводится с помощью целого ряда специальных подходов, из которых наиболее важными являются методы клинико-неврологического анализа. Серьезным подспорьем для практического врача может стать применение вопросников и шкал для верификации и количественной оценки боли. Для утверждения того, что боль является нейропатической, необходимо иметь аргументы, свидетельствующие о появлении боли вследствие повреждения или органического заболевания соматосенсорной нервной системы.
Для выявления нейропатического характера болевого синдрома предложен подход, образно называющийся принципом «трех С» (рис. 18). Первое С – слушать больного внимательно, отмечая характерные элементы описания нейропатической боли. Второе С – смотреть, т. е. необходимо выявить и оценить локальные нарушения чувствительности. Третье С – соотносить характер предъявляемых жалоб с результатами объективного осмотра.
Этот принцип применим к большинству сложных диагностических ситуаций и лишь подчеркивает необходимость тщательного анализа жалоб и клинической картины. Данные анамнеза. Собирая его, врачу чрезвычайно важно слушать рассказ пациента о боли. Необходимо предложить больному как можно подробнее описать свои болевые ощущения.
Рисунок 18. Kлинический подход «три С» в диагностике нейропатической боли
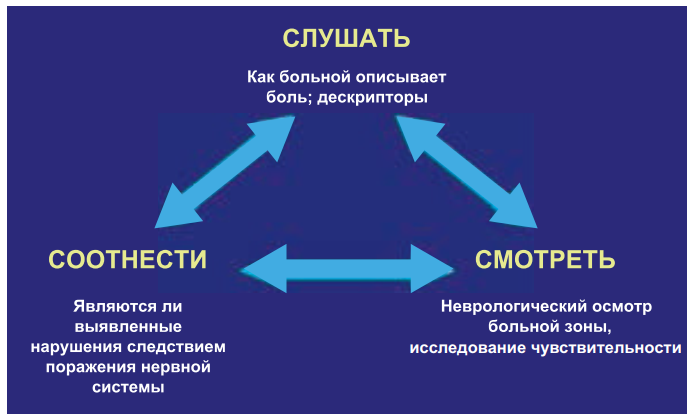
Именно анализ характеристик боли, указываемых самим пациентом, помогает заподозрить нейропатический тип боли. Также следует выяснить локализацию боли, ее распространенность, интенсивность и длительность. В результате последних исследований было показано, что для нейропатической боли характерны большая длительность болевого синдрома и его интенсивность. Кроме того, подробный расспрос позволит выделить спонтанные и вызванные компоненты болевого синдрома, что также важно для диагностики. Заподозрить нейропатический тип боли можно на основании неэффективности предшествующей терапии ненаркотическими анальгетиками и НПВП. Пациенты могут описывать свои болевые ощущения следующим образом: неприятные, колющие, кинжальные, жгучие, ошпаривающие, ноющие, как от удара электрическим током или как глубокую мучительную боль. Для ряда состояний характерна аллодиния, вызванная прикосновением холодных предметов. В этом случае боль будет описываться как холодная, влажная, ледяная или даже такими парадоксальными словами, как жгуче-ледяная или жгуче-теплая. Некоторые пациенты с центральной постинсультной болью жалуются на болевые ощущения, провоцируемые движением. Они характеризуются стягивающими, сжимающими и жгучими ощущениями в коже. У части больных боль может носить пароксизмальный характер и описываться как колющая, стреляющая или ланцинирующая. Не всегда пациенты могут полно и правильно описать свои болевые ощущения. В этом случае врачу необходимо помочь им подобрать те слова, которые наиболее полно и четко характеризуют боль.
Клинические методы количественной оценки позитивных и негативных симптомов при нейропатической боли представлены в таблицах 2 и 3. Кроме количественной оценки неврологическое обследование пациентов с подозрением на нейропатическую боль должно включать в себя картирование двигательных, сенсорных и вегетативных феноменов с целью идентификации всех признаков неврологической дисфункции.
Таблица 2. Клиническая оценка позитивных симптомов при нейропатической боли
| Позитивные симптомы и признаки | Методы оценки | |
| Спонтанные
симптомы |
Парастезия | Анамнез, опрос (баллы от 0 до 10) |
| Дизестезия | Анамнез, опрос (баллы от 0 до 10) | |
| Пароксизмальная боль | Анамнез, опрос (баллы от 0 до 10) | |
| Поверхностная жгучая боль | Анамнез, опрос (баллы от 0 до 10) | |
| Глубокая боль | Анамнез, опрос (баллы от 0 до 10) | |
| Вызванные
симптомы |
Статическая гипералгезия | Легкое механическое надавливание |
| Гипералгезия при прикосновении | Прикосновение кисточкой | |
| Гипералгезия на укол иглой | Укол иглой | |
| Повторяющаяся гипералгезия на укол иглой | Уколы иглой с интервалами в 2 сек, наносимые непрерывно в течение 30 сек | |
| Ощущение боли, сохраняющееся после стимула | Измерение длительности ощущения боли после прекращения стимула | |
| Холодовая гипералгезия | Прикосновение холодного терморолика | |
| Тепловая гипералгезия | Прикосновение теплого терморолика | |
| Химическая гипералгезия | Капсаицин местно | |
| Симпатическая поддерживаемая боль | В настоящий момент отсутствуют |
Таблица 3. Клиническая оценка негативных симптомов при нейропатической боли
| Негативные симптомы и признаки | Методы оценки |
| Пониженная чувствительность к прикосновению | Прикосновение кусочком ваты |
| Пониженная чувствительность к уколу | Единичный укол иглой |
| Пониженная чувствительность к температурным стимулам | Тепловая/холодовая проба (45° и 20° соответственно) |
| Снижение вибрационной чувствительности | Исследование с помощью камертона |
Неврологическое обследование желательно завершать оценкой чувствительности. Полезно вести детальную запись всех чувствительных нарушений (предпочтительно в форме диаграммы), дающую возможность сравнивать изменения при повторных обследованиях. Тактильную чувствительность лучше всего оценивать с помощью кусочка ваты или монофиламента, чувствительность к уколу – с помощью тупой иглы, температурную чувствительность – с помощью теплых и холодных предметов (например, металлических термороликов), чувствительность к вибрации – с помощью камертона 128 Гц. Сравнительно недавно международные эксперты под руководством R.D. Treede (2008) для диагностики нейропатической боли предложили воспользоваться критериями градации вероятности диагноза (табл. 4).
Таблица 4. Диагностические критерии нейропатической боли

Диагностика с использованием данного алгоритма базируется на четырех критериях. Прежде всего необходимо определить, локализуется ли боль в нейроанатомической зоне. Например, при нейропатической боли периферического характера боль и сенсорные нарушения должны соответствовать зоне иннервации соответствующих нервов, сплетений и корешков.
Вторым шагом предлагается установить взаимосвязь между анамнезом заболевания, вызвавшего нейропатическую боль, и локализацией и нейроанатомическим распределением самой боли и сенсорных расстройств.
Третий критерий – наличие позитивных и негативных сенсорных симптомов, методы их оценки подробно разобраны выше. И, наконец, необходимо по возможности подтвердить объективно поражение соматосенсорной нервной системы (КТ или МРТ, ЭНМГ или ВП). Если у пациента имеются в наличии все четыре критерия, диагноз нейропатической боли достоверен.
Диагноз нейропатической боли высоковероятен, когда в наличии имеются критерии 1 и 2 плюс один из двух оставшихся, т. е. 3 или 4. Наличие у пациента нейропатической боли расценивается как возможное в том случае, если подтверждаются только критерии 1 и 2. Согласно предложенному алгоритму диагноз нейропатической боли следует считать полностью подтвержденным только тогда, когда он соответствует градациям, достоверен и высоковероятен.
В терапии нейропатической боли предлагается использовать комплексный многомерный подход. Даже в рамках амбулаторной помощи может быть начато лечение несколькими разными методами. На сегодняшний день существует недостаточное количество доказательных данных о пользе применения консервативных немедикаментозных методов лечения (например, физиотерапии, физических упражнений, чрескожной электронейростимуляции). Однако, учитывая относительную безопасность этих методов, при отсутствии противопоказаний не следует исключать возможность их применения. Наиболее признанной в лечении нейропатической боли на сегодняшний день является фармакотерапия. Ниже приведены рекомендации Европейской федерации неврологических обществ (EFNS) по терапии нейропатической боли, основанные на принципах доказательной медицины (Eur J Neurol. 2010 Sep;17(9):1113-e88. doi: 10.1111/j.1468-1331.2010.02999.x. Epub 2010 Apr 9/ EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Attal N., Cruccu G., Baron R., Haanpää M., Hansson P., Jensen T.S., Nurmikko T.; European Federation of Neurological Societies) (табл. 5). Лечение нейропатической боли – длительный процесс, который требует регулярного контроля состояния здоровья пациента и выполнения врачебных назначений. В начале терапии особое внимание следует обращать на правильное титрование дозы препаратов и отслеживать возможность развития лекарственных взаимодействий. В процессе лечения требуется регулярно опрашивать больного относительно соблюдения им схемы лечения, решать вопрос о необходимости продолжения приема препарата и оценивать его эффективность.
Таблица 5. Eвропейские рекомендации по терапии постгерпетической невралгии, тригеминальной невралгии, болевых полинейропатий и центральной нейропатической боли
|
Состояния, сопровождающиеся нейропатической болью |
Препараты первого ряда терапии |
Методы второго и третьего ряда терапии |
| Постгерпетическая невралгия | Прегабалин, габапентин, лидокаин местно (в случае небольшого участка боли или аллодинии) | Капсаицин, опиоиды, трамадол |
| Тригеминальная невралгия | Карбамазепин, окскарбазепин | Хирургическое лечение |
| Болевые полинейропатии | Прегабалин, габапентин, ТЦА | Ламотриджин, опиоиды, СИОЗСН, трамадол |
| Центральная нейропатическая боль | Прегабалин, амитриптилин, габапентин | Каннабиноиды, ламотриджин, опиоиды |
6. Комплексный регионарный болевой синдром
Под термином «комплексный регионарный болевой синдром» (КРБС) подразумевается синдром хронической боли, проявляющийся выраженной постоянной болью в конечности в сочетании с локальными вегетативными расстройствами и трофическими нарушениями, возникающий чаще всего после различных периферических травм. Вместе с тем вопросы терминологии, классификации, патогенеза и лечения этого синдрома во многом остаются дискуссионными.
Под КРБС объединены два типа расстройств. Наиболее распространенным (тип I) является расстройство, известное под названием «рефлекторная симпатическая дистрофия» (РСД). Второе (тип II) подпадает под классическое описание каузалгии. Вопрос о возможности третьего типа КРБС у тех пациентов, которые не соответствуют критериям I или II типов, остается открытым.
Диагностическими критериями КРБС типа I являются симптомы, которые, как правило, развиваются после травматического события или в результате иммобилизации. Эти симптомы имеют следующие особенности: постоянная боль, аллодиния или гиперестезия, при этом боль неадекватна раздражителям; одновременное наличие отека, изменения кровотока в коже (например, цвета или температуры) или патологической судомоторной активности (например, избыточное потоотделение или сухость) в пораженной области. Диагноз установлен методом исключения заболеваний, которые могли бы объяснить выраженность боли и нарушение функции (например, диабетическая периферическая невропатия, болезнь Рейно и тромбоз). Для КРБС типа II характерны те же основные признаки, что и для типа I.
Главное отличие заключается в указании в анамнезе на повреждение нерва. Как правило, это повреждение крупных нервов, например, срединного или седалищного. Боль при типе II не всегда ограничена зоной иннервации поврежденного нерва. Классические симптомы и признаки, такие как жгучая боль и некоторые дистрофические изменения, ранее считавшиеся основополагающими, были пересмотрены, поскольку для этого появились определенные основания.
Принятие Международной ассоциацией по изучению боли (IASP) этих критериев было лишь еще одной вехой динамического развития противоречий в понимании КРБС. С момента введения этих критериев они подвергались критике за неопределенность, поскольку это создавало возможность для гипердиагностики синдрома, а также за отказ от некоторых ключевых знаков и симптомов, которые многие считали определяющими. В дальнейшем было предложено усовершенствовать критерии IASP, отделив вазомоторные симптомы (изменение температуры и цвета кожи или асимметрию) от признаков, отражающих судомоторную дисфункцию (изменение потоотделения или асимметрию) и отек. Также было показано, что моторные изменения (сокращение объема движений, слабость, тремор и дистония) являются важным и отличительным компонентом КРБС.
КРБС типа I характеризуется постоянной болью в определенной части конечности после травмы, не воздействующей на крупные нервные стволы. Боль обычно наблюдается в дистальном отделе конечности, прилежащем к травмированной области, или в таких местах, как колено и бедро, 1–2 пальца на кисти или стопе. Боль, которая, как правило, возникает через несколько недель после первоначальной травмы, ощущается как жгучая и постоянная, усиливается при движениях, кожной стимуляции и стрессе. Усиление боли при эмоциональных нагрузках, движении является характерным.
КРБС типа II сопровождается жгучей болью, аллодинией и гиперпатией в соответствующей руке или стопе. Обычно боль начинается сразу после травмы или ранения нерва, но может проявиться и спустя несколько месяцев. Вначале спонтанная боль локализуется в зоне иннервации поврежденного нерва, а затем может охватывать и более обширные зоны. Вегетативные нарушения при КРБС двух типов в целом идентичны и включают вазомоторные и судомоторные расстройства. К первым относят отек, выраженность которого может варьировать, а также нарушения периферического кровообращения (вазоконстрикторные и вазодилатационные реакции) и кожной температуры, изменения цвета кожи. Судомоторные расстройства проявляются симптомами локального повышенного (гипергидроз) или сниженного потоотделения (гипогидроз). Дистрофические изменения при КРБС могут охватывать практически все ткани конечности. Отмечаются снижение эластичности кожи, гиперкератоз, изменения волосяного покрова (локальный гипертрихоз) и роста ногтей, атрофия подкожной клетчатки и мышц, мышечные контрактуры, тугоподвижность суставов.
Характерными для КРБС являются деминерализация костей и развитие регионарного остеопороза. В конце 1990-х гг. были опубликованы основополагающие принципы лечения КРБС, выработанные на международном симпозиуме, где присутствовали ведущие в данной области ученые и практикующие врачи. Важно отметить, что эти принципы отражают информированное мнение экспертов, в то время как экспериментальная база данных как контролируемых, так и неконтролируемых клинических испытаний все еще остается недостаточной. С учетом этого следует отметить, что рекомендуется координированный подход. Он построен в виде алгоритма лечения с акцентом на физиотерапии и лечебной физкультуре и предназначен для нормализации функций. Физиотерапия назначается в сочетании с другими методами (медикаменты; анальгетики, включая препараты для региональной анестезии; нейромодуляция через периферический нерв или стимуляция спинного мозга; другие средства, включая психотерапию), разработанные для облегчения достижения данной цели.
Лечение, основанное на биопсихосоциальной концепции, осуществляемое многопрофильными бригадами, считается основополагающим, при этом пациент является ключевой фигурой. Акцент делается на самоуправлении и на вмешательствах без применения высоких технологий, в то время как инвазивные вмешательства (региональная анестезия, нейромодуляция и нейростимуляция) остаются резервом для тех случаев, когда не удается достичь ожидаемой положительной динамики. Психологические вмешательства являются ключевым элементом процесса реабилитации.
При медикаментозной терапии возможно применение следующих препаратов:
- НПВП при умеренной выраженности синдрома и в качестве дополнительного средства при сопутствующем воспалительном процессе в суставах или сухожилиях;
- ТЦА (например, амитриптилин, дезипрамин и доксепин) и другие гетероциклические (например, мапротилин) антидепрессанты, которые часто оказывают болеутоляющее действие, а также влияют на настроение и сон при нейропатических болевых синдромах, например, при диабетической невропатии и постгерпетической невралгии (но не всегда при КРБС);
- ингибиторы обратного захвата серотонина (например, флуоксетин и пароксетин) в тех случаях, когда на первый план выходят тревожность и депрессия;
- «стабилизаторы мембран» и противосудорожные средства (например, карбамазепин, прегабалин, габапентин и вальпроевая кислота);
- анестетики местного действия (например, лидокаин);
- противоаритмические средства (например, мексилитин);
- кортикостероиды;
- кальцитонин, бисфосфонаты;
- крем с капсаицином для аппликаций в области гипералгезии;
- альфа-блокаторы (например, празозин и феноксибензамин);
- опиоиды.
Хотя вопрос о применении опиоидов достаточно противоречив, и в целом они считаются неэффективными при нейропатической боли, для некоторых пациентов это может оказаться полезным.
Дополнительно используются методы местного обезболивания, нейромодуляции и зеркальной терапии.
7. Фибромиалгия
Это комплексное расстройство с распространенной мышечно-скелетной болью, депрессией, нарушением сна, утренней скованностью, усталостью. Для болезни характерно также наличие на теле болезненных участков – так называемых болевых точек. Женщины более подвержены развитию этой болезни, чем мужчины. Среди всех форм хронических болевых синдромов фибромиалгия является лидером по представленности депрессии, степени дезадаптации пациентов, страдающих этим заболеванием, т. е. по степени снижения качества их жизни.
В 1990 г. Американской коллегией ревматологов были разработаны методические рекомендации по диагностике фибромиалгии – критерии АКР (табл. 6). Хотя они не предназначены для использования в клинических условиях, а только в рамках исследований, тем не менее они обеспечивают точность свыше 85% в дифференциальной диагностике фибромиалгии и похожих заболеваний.
В 2010 г. были предложены новые диагностические критерии фибромиалгии (табл. 7) [Wolf F., Clauw D.J., Fitzcharles M.-A. et al. The
Таблица 6. Диагностические критерии и клинические характеристики фибромиалгии (Американская коллегия ревматологов, 1990)
| Критерий АКР | Определение |
| Анамнез диффузной боли (более 3 месяцев) | Боль считается диффузной, если она присутствует в 4 квадрантах тела (слева и справа, выше и ниже пояса). Должна присутствовать боль в осевом скелете (шейный отдел позвоночника, или передняя часть грудной клетки, или грудной отдел позвоночника, или поясница). Боль в плечах и ягодицах рассматривается как боль для каждой пораженной стороны |
| Боль в 11 из 18 болезненных точек при пальпации | Затылок: двусторонние, в области затылочных мышц |
| Нижняя часть шеи: билатерально, спереди от С5–С7 | |
| Трапециевидные: билатерально, в средней части верхней границы | |
| Надостные: билатерально, над остью лопатки с медиального края | |
| Второе ребро: билатерально, в районе второго костно-хрящевого сустава, немного латеральнее | |
| Латеральный надмыщелок: билатерально, 2 см дистальнее надмыщелков | |
| Ягодичные: билатерально, верхний наружный квадрант ягодиц | |
| Большой вертел: билатерально, кзади от вертлужного бугорка | |
| Колено: билатерально, медиальнее коленного сустава | |
| Клинические симптомы | Описание со слов пациента |
| Повышенная утомляемость | Вялость, отсутствие мотивации, трудности при движении или физической нагрузке |
| Качество жизни | Влияние на способность составлять планы, достигать целей или выполнять задания |
| Общие функции | Снижение повседневной бытовой активности |
| Болезненность | Болезненность при касании |
| Сон | Плохое засыпание, поверхностный сон, вялое пробуждение |
| Нарушение когнитивных функций | Трудности концентрации внимания, заторможенность |
| Ригидность | Скованность по утрам |
| Депрессия/ тревожность | Чувство усталости, разочарования, грусть |
Таблица 7. Диагностические критерии фибромиалгии (2010)

American College of Rheumatology Preliminary Diagnostic Criteria for Fibromyalgia and Measurement of Symptom. Severity. Arthr Care Res 2010;62(5):600–617].
Для использования данных критериев необходимы два параметра: болевой индекс (БИ) и шкала тяжести симптомов (ШТС). Для расчета БИ больному предлагается указать, в каких конкретно из 19 областей тела он испытывал боль за последнюю неделю (табл. 8). Для каждой области присваивается 1 балл, и общий счет БИ может колебаться от 0 до 19. Кроме оценки БИ, в диагностике фибромиалгии применяется общий счет по шкале тяжести симптомов (ШТС), который представляет собой сумму тяжести трех признаков (утомляемость, нарушение сна, когнитивные симптомы) + общая степень выраженности соматических симптомов. Финальная оценка колеблется от 0 до 12 баллов. Для каждого из этих трех симптомов определяют выраженность его в течение последней недели по следующей шкале: 0 баллов – нет нарушений; 1 балл – легкие и незначительные нарушения, обычно малозаметные или преходящие; 2 балла – умеренной выраженности и значительные нарушения, много раз появляющиеся, и/или постоянные умеренной выраженности; 3 балла – тяжелые нарушения, постоянные, длительные, жизнеугрожающие.
Таблица 8. Оценка болевого индекса (БИ)
| БИ: укажите число областей, в которых пациент испытывал боль в течение последней недели | |
| Плечевой пояс, слева | Плечевой пояс, справа |
| Верхняя часть руки, слева | Верхняя часть руки, справа |
| Нижняя часть руки, слева | Нижняя часть руки, справа |
| Бедро (ягодица, большой вертел), слева | Бедро (ягодица, большой вертел), справа |
| Верхняя часть ноги, слева | Верхняя часть ноги, справа |
| Нижняя часть ноги, слева | Нижняя часть ноги, справа |
| Челюсть, слева | Челюсть, справа |
| Грудная клетка | |
| Живот | |
| Верхняя часть спины | |
| Нижняя часть спины | |
| Шея | |
Суммарно этот раздел ШТС может быть оценен от 0 до 9 баллов. Кроме того, для окончательного подсчета ШТС у больного необходимо оценить наличие следующих соматических симптомов: мышечная боль (миалгия), СРК, утомление/усталость, расстройства мышления или памяти, мышечная слабость, головная боль, боль/рези в животе, онемение/покалывание, головокружение, нарушение сна, депрессия, запор, боль внизу живота, тошнота, нервозность, боль в грудной клетке, расплывчатое видение, лихорадка, сухость во рту, зуд, визинг (шумное дыхание), феномен Рейно, крапивница/рубцы, звон в ушах, рвота, изжога, язвы ротовой полости, утрата/изменение вкуса, сухость в глазах, одышка, утрата аппетита, сыпь, фоточувствительность, нарушение слуха, легкий ушиб, облысение, учащенное мочеиспускание, болезненное мочеиспускание. Всего оценивают 40 симптомов. Предлагается следующая градация наличия этих признаков: 0 баллов – нет симптомов; 1 балл – мало симптомов; 2 балла – умеренное число симптомов; 3 балла – большое число симптомов. Суммарная оценка по ШТС с учетом соматической симптоматики может колебаться от 0 до 12 баллов. Как видно, в новых критериях в меньшей степени делается акцент на наличие триггерных точек и в значительной мере уделяется внимание неболевым феноменам и коморбидности. Пока эти критерии являются предварительными, поскольку они не прошли проверку в широкой клинической практике.
8. Лечение
В течение последних десятилетий все больше исследователей подчеркивали важность комплексного рассмотрения факторов, связанных с фибромиалгией. Были разработаны различные виды многопрофильных программ лечения фибромиалгии, хотя эти программы, как правило, имеют ряд общих компонентов, в том числе физические упражнения, образовательную часть и некоторые виды когнитивного лечения для улучшения психофизиологической адаптации. Доказанная эффективность многопрофильных терапевтических программ свидетельствует о том, что сочетание медикаментозного лечения, физической нагрузки и когнитивно-поведенческого компонента является методом выбора для лечения всех пациентов с фибромиалгией.
В 2010 г. были опубликованы международные рекомендации по лечению фибромиалгии, основанные на принципах доказательной медицины [G J Macfarlane, C Kronisch, L E Dean, F Atzeni, W Häuser, E Fluß, E Choy, E Kosek, K Amris, J Branco, F Dincer, P Leino-Arjas, K Longley, G M McCarthy, S Makri, S Perrot, P SarziPuttini, ATaylor, GT Jones. EULAR revised recommendations for the management of fibromyalgia. Ann Rheum Dis doi:10.1136/annrheumdis-2016-209724].
Немедикаментозное лечение. Специально проведенный анализ различных немедикаментозных методов лечения фибромиалгии показал, что достоверной эффективностью обладают когнитивно-поведенческая терапия и различные виды физической активности (табл. 9). На фоне проведения терапии с помощью этих методов лечения отмечалось стойкое улучшение симптомов фибромиалгии на протяжении 1 года и более.
Таблица 9. Нефармакологическое лечение фибромиалгии
| Нефармакологическое лечение | Степень доказательности |
| Аэробика и другие программы тренировки силы | А |
| Когнитивно-поведенческая терапия | А |
| Мультикомпонентная терапия | А |
| Акупунктура и плавание в бассейне | А |
| Йога и другие виды терапии, снижающие стресс | А |
Медикаментозное лечение фибромиалгии. Согласно рекомендациям 2010 г. наиболее эффективными и безопасными в терапии фибромиалгии являются антидепрессанты, прегабалин, трамадол и циклобензаприн (не зарегистрирован в РФ) (табл. 10).
Таблица 10. Фармакологическое лечение фибромиалгии
| Фармакологическое лечение | Степень доказательности |
| Низкие дозы амитриптилина | А |
| Дулоксетин или милнаципран | А |
| Трамадол | А |
| Прегабалин | А |
| Циклобензаприн | А |
Антидепрессанты. Среди лекарственных препаратов одними из первых для лечения болевого синдрома при фибромиалгии были использованы ТЦА. Было показано, что амитриптилин способен купировать интенсивность боли, укреплять сон и снижать утомляемость больных с фибромиалгией. При этом антидепрессанты из группы СИОЗС (флуоксетин, сертралин, циталопрам, пароксетин) показали низкую эффективность в ходе рандомизированных плацебо-контролируемых исследований при фибромиалгии.
Ингибиторы обратного захвата серотонина и норадреналина (ИОЗСН) (венлафаксин, дулоксетин, милнаципран) оказались более эффективными, чем СИОЗС. Эти препараты, так же как и ТЦА, ингибируют обратный захват серотонина и норадреналина, однако в отличие от ТЦА практически не влияют на другие рецепторы. Такая избирательность приводит к снижению побочных эффектов и лучшей переносимости ТЦА.
Антиконвульсанты. Прегабалин, лиганд α2-d кальциевых каналов применяется для лечения нейропатической боли. Это был первый препарат, утвержденный FDA для лечения фибромиалгии. Прегабалин является первым и пока единственным препаратом в России, официально зарегистрированным для лечения фибромиалгии. Прегабалин связывается с α2-d участком потенциалзависимых кальциевых каналов в ЦНС. Вследствие уменьшения притока кальция внутрь нейронов снижается высвобождение субстанции P, глутамата и норадреналина, обеспечивая анальгезирующее и анксиолитическое действие прегабалина. Активность этого препарата ограничена нейронами и не влияет на сосудистые кальциевые каналы.
Фармакологические свойства габапентина сходны с таковыми прегабалина. Габапентин применяли в ходе 12-недельного РКИ с участием 150 пациентов с фибромиалгией. В группе получавших габапентин отмечалось достоверное снижение среднего балла интенсивности боли по сравнению с группой лечившихся плацебо. Кроме того, на фоне применения габапентина значительно улучшались баллы по шкале тяжести фибромиалгии (FIQ), шкале самостоятельной оценки пациентом своего состояния (PGIC) и по шкале оценки качества сна. По сравнению с плацебо габапентин приводил к значительному повышению частоты встречаемости седативного эффекта, дурноты и головокружения.
Трамадол. Это анальгетик центрального действия, который связывается с μ-опиоидными рецепторами и ингибирует обратный захват норадреналина и серотонина. Комбинация парацетамола (ацетаминофен) с трамадолом в отношении 8:1 показала синергизм обоих препаратов в условиях доклинических моделей боли.
Бензодиазепины. Эффективность бензодиазепинов в лечении фибромиалгии до конца не изучена. Многие исследования дали противоречивые результаты. Например, бензодиазепины, включая алпразолам (0,5–3,0 мг перед сном), не показали преимущества перед плацебо для лечения боли при фибромиалгии, но клоназепам достаточно эффективно купировал болевой синдром височно-нижнечелюстного сустава, который часто наблюдается при фибромиалгии. Кроме того, этот препарат достаточно эффективно купировал синдром беспокойных ног, который является частой причиной беспокойного и прерывистого сна у пациентов с фибромиалгией.
Местные анестетики. Системное применение лидокаина показано для лечения пациентов с фибромиалгией: однократные и курсовые инфузии лидокаина в дозе 5–7 мг/кг приводили к достаточно заметному снижению интенсивности боли у пациентов с фибромиалгией.
На сегодняшний день всеми специалистами подчеркивается необходимость комплексного мультимодального подхода к терапии фибромиалгии, основанного на принципах биопсихосоциального подхода, включающего как фармакологические, так и нелекарственные методы.
9. Соматоформные болевые расстройства
Суть идеи соматоформных расстройств состоит в том, что физические симптомы невозможно объяснить соматической патологией или альтернативными психиатрическими диагнозами. Согласно DSM-IV и DSM-V соматоформные расстройства – это «наличие физических симптомов, предполагающих соматическое заболевание (что видно из названия), однако после обследования оказывается, что эти симптомы нельзя полностью объяснить общим заболеванием, непосредственным воздействием химического вещества или другим психическим расстройством». Далее говорится, что симптомы должны быть клинически значимыми (это определяется на основании существующего дистресса или нарушения функции) и, в отличие от ложного расстройства или симуляции, должны возникать непреднамеренно и спонтанно.
В таблице 11 приведены рабочие критерии соматоформного болевого расстройства согласно определению «Диагностико-статистического руководства по психическим расстройствам» (DSM-IV; Американская психиатрическая ассоциация, 1994).
Согласно МКБ-10 устойчивое соматоформное болевое расстройство – это состояние, сопровождающееся мучительной, длительной физически и психически труднопереносимой болью, которая не имеет физиологических объяснений и не является следствием соматической болезни, но часто сочетается с психосоциальными проблемами, конфликтами и позволяет пациенту получать вторичную выгоду в виде повышенного внимания со стороны родственников и врачей.
Таблица 11. Диагностические критерии DSM-IV соматоформного болевого расстройства

В МКБ-10 есть отдельная рубрика «Устойчивое соматоформное болевое расстройство» (F 45.4), куда включаются психалгия, психогенная боль в спине, психогенная головная боль, соматоформное болевое расстройство. Исключаются боль острая (R 52.0), боль неустранимая (R 52.1), боль хроническая (R 52.2), головная боль напряжения (G 44.2).
Лечение состоит в следующем: 1) добиться большего контроля над болью с помощью физических, фармакологических и психологических средств; 2) восстановить, насколько это возможно, нормальное функционирование; 3) снизить уровень дистресса, связанного с болью; 4) обеспечить независимость пациента с помощью управления болью; 5) постепенно снизить количество обращений за помощью к медицинскому персоналу и сократить использование ресурсов.
Медикаментозное лечение включает применение антидепрессантов, транквилизаторов, нейролептиков в зависимости от характера и выраженности психопатологии. Из антидепрессантов полезны селективные ингибиторы обратного захвата серотонина (СИОЗС), особенно в тех случаях, когда пациент страдает паническим и/или депрессивным расстройством. Важно соблюдать правила их применения (длительность применения – не менее 6 месяцев и регулярность приема).