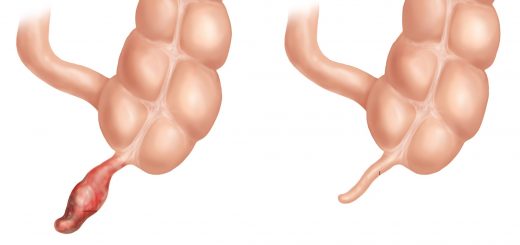
Синдром портальной гипертензии
Содержание страницы
Проблема диагностики и лечения синдрома портальной гипертензии (ПГ) продолжает оставаться актуальной в настоящее время. В экономически развитых странах, несмотря на прогресс в подходах к диагностике и лечению, хронические заболевания печени и цирроз печени входят в число шести основных причин смерти пациентов от 35 до 60 лет. В республике Беларусь 1,5 тыс. людей ежегодно заболевают циррозом, смертность от цирроза печени и портальной гипертензии составляет около 35 случаев на 100 тыс. населения и имеет тенденцию к увеличению. Средняя летальность в европейском регионе в 2011г составила 22 на 100 тыс. населения, а среди мужчин в возрасте 50–69 лет смертность достигла 69 на 100 тыс. населения в год.
Портальная гипертензия — это клинический симптомокомплекс, который гемодинамически проявляется патологическим повышением портального градиента давления, что сопровождается формированием портосистемных коллатералей, через которые происходит сброс крови из воротной вены в обход печени. Портальный градиент давления — разница между давлением в воротной и нижней полой венах, в норме он составляет 1– 5 мм рт. ст. Клинически значимой портальная гипертензия становится при повышении портального градиента давления >10 мм рт.ст.
Синдром портальной гипертензии развивается при повышении давления в системе воротной вены, вызванном нарушением кровотока на различных уровнях абдоминальной венозной системы (в портальных сосудах, печеночных венах, нижней полой вене). Портальное давление в норме составляет 5–7 мм рт.ст. Клинически значимым является повышение давления в воротной вене более 12 мм рт. ст. (170–200 мм вод. ст.)
Анатомия портальной системы
Портальная система (система воротной вены) — группа вен, собирающих кровь от непарных органов брюшной полости (желудок, поджелудочная железа, селезенка, кишечник). Эти органы получают артериальную кровь из чревной, мезентериальных и селезеночной артерий, которая затем поступает в так называемую первую сеть капилляров портального русла, расположенную в кишечнике, желудке, поджелудочной железе и селезенке. Далее она направляется в венулы, вены и в воротную вену, затем в печень в так называемую вторую сеть капилляров портального русла (печеночные синусоиды). Оттуда кровь по системе печеночных вен попадает в нижнюю полую вену, покидая портальное русло (рисунок 1).
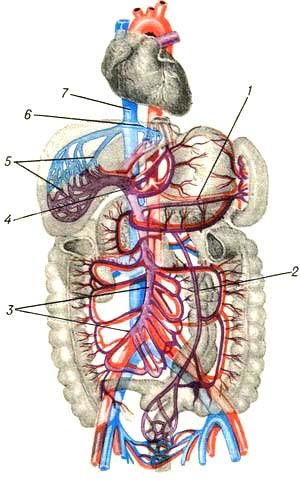
Рисунок 1 — Схема портального кровообращения: 1 — селезеночная вена; 2 — нижняя брыжеечная вена; 3 — верхняя брыжеечная вена; 4 — воротная вена; 5 — разветвление сосудов в печени; 6 — печеночная вена; 7 — нижняя полая вена.
Одним из основных условий нормального кровообращения в любой сосудистой системе является разность давления между различными ее точками. В системе портального кровообращения артериальная кровь под давлением 110–120 мм рт. ст. поступает в первую сеть капилляров, где оно понижается до 10–15 мм рт. ст. В воротной вене давление составляет 5– 10 мм рт. ст., а в печеночных венах — 0–5 мм рт. ст. Таким образом, разность давления в начальном и конечном отделах портального русла, обеспечивающая поступательное движение крови, составляет свыше 100 мм рт. ст.
Между венами портальной системы и венами системы полых вен существуют межсистемные анастомозы. Венозные анастомозы играют исключительно важную роль в распределении крови в областях организма и приобретают особое значение в патологии при нарушениях кровотока в основных венозных магистралях или их притоках, обеспечивая коллатеральное кровообращение.
Портокавальные анастомозы представляют собой систему соустий между притоками воротной вены и притоками верхней и нижней полых вен, а кавакавальные анастомозы — систему соустий между притоками верхней и нижней полых вен (рисунок 2).
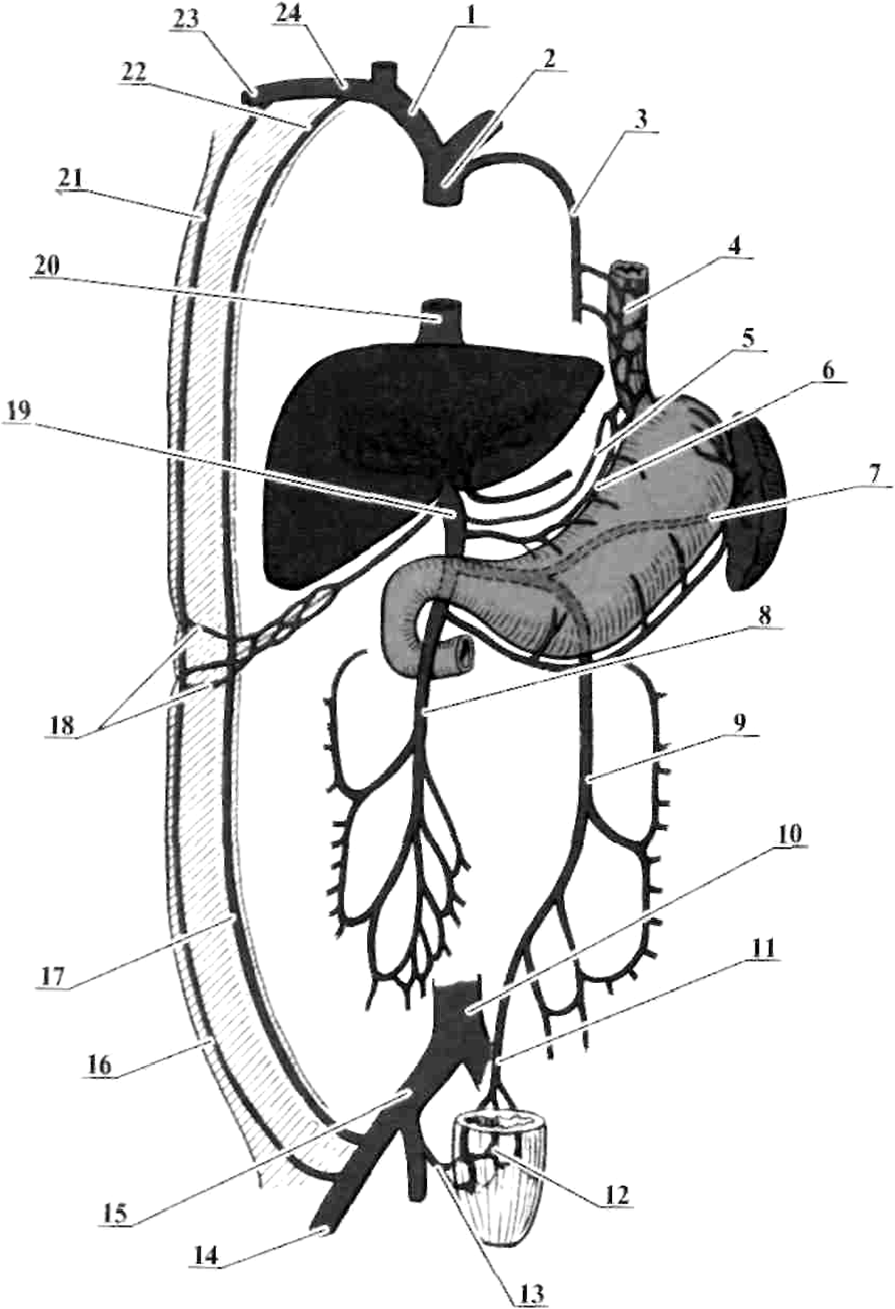
Pисунок 2 — Схема межсистемных венозных анастомозов:1 — v. brachiocephalica; 2 — v. cava superior; 3 — v. azygos; 4 — vv. oesophageales; 5 — v. gastrica sinistra; 6 — v. gastrica dextra; 7 — v. lienalis; 8 — v. mesenterica superior; 9 — v. mesenterica inferior; 10 — v. cava inferio r; 11 — v. rectalis superior; 12 — plexus venosus rectalis; 13 — vv. rectales media et inferior; 14 — v. femoralis; 15 — v. iliaca communis; 16 — v. epigastrica superficialis; 17 — v. epigastrica inferior; 18 — vv. paraumbilicales; 19 — v. porta hepatis; 20 — v. cava inferior; 21 — v. thoracoepigastrica; 22 — vv. epigastricae superiores; 23 — v. axillaris; 24 — v. subclavia.
Основные зоны портокавальных анастомозов: Портокавальные анастомозы пищевода (имеют наибольшее клиническое значение).
В стенке брюшной части пищевода залегают венозные сплетения, из которых кровь оттекает по: левой желудочной вене (v. gastrica sinistra) в воротную вену; пищеводным венам (vv. esophageae) в непарную (v. azygos) и полунепарную вены (v. hemyazygos) системы верхней полой вены.
Портокавальные анастомозы прямой кишки
В стенке прямой кишки находятся прямокишечные венозные сплетения
(plexus venosus rectalis), путями венозного оттока из которых являются:
Верхняя прямокишечная вена (v. rectalis superior) — отток крови от верхних отделов прямой кишки в нижнюю брыжеечную вену (v. mesenterica inferior) системы воротной вены.
Средние прямокишечные вены (vv. rectales mediae). По ним кровь оттекает от среднего отдела прямой кишки через внутреннюю подвздошную вену (v. iliaca interna) в общую подвздошную вену (v. iliaca communis) системы нижней полой вены.
Нижние прямокишечные вены (vv. rectales inferior) — отток крови от нижнего отдела прямой кишки (области заднего прохода) через внутреннюю половую вену (v. pudenda interna) и внутреннюю подвздошную вену (v. iliaca interna) в общую подвздошную вену (v. iliaca communis) системы нижней полой вены.
Портокавальные анастомозы передней брюшной стенки
В передней брюшной стенке в области пупка анастомозируют притоки:
- околопупочных вен (vv. paraumbilicalis), проходящих в круглой связке печени, системы воротной вены;
- верхней надчревной вены (v. epigastrica superior), которая через внутреннюю грудную вену (v. thoracica interna) и подключичную вену (v. subclavia) впадает в плечеголовную вену (v. brahiocephalica) системы верхней полой вены;
- грудонадчревной вены (v. thoracoepigastrica), которая впадает в подмышечную вену (v. axillaris) системы верхней полой вены;
- поверхностной надчревной вены (v. epigastrica superficialis), которая через бедренную вену (v. femoralis), а затем наружную подвздошную вену (v. iliaca externa) впадает в общую подвздошную вену (v. iliaca communis) системы нижней полой вены;
- нижней надчревной вены (v. epigastrica inferior), которая через наружную подвздошную вену (v. iliaca externa), впадает в общую подвздошную вену (v. iliaca communis) системы нижней полой вены.
Портокавальные анастомозы задней стенки брюшной полости
В поясничной области, в непокрытых брюшиной отделах восходящей и нисходящей ободочных кишок двенадцатиперстной кишки, поджелудочной железы между собой анастомозируют:
- притоки селезеночной вены (v. lienalis) системы воротной вены;
- притоки верхней и нижней брыжеечных вен (vv. mesenterica superior et inferior) система воротной вены;
- притоки поясничных вен (vv. lumbales) системы нижней полой вены.
Классификация портальной гипертензии
По этиологии:
Врожденная (первичная, связанная с аномалиями развития вен):
- атрезия или гипоплазия воротной вены;
- кавернозная дисплазия воротной вены;
- мембранозное заращение конечного отдела нижней полой вены.
Приобретенная (вторичная):
- цирроз печени;
- тромбоз воротной вены или ее ветвей;
- окклюзия печеночных вен;
- тромбоз или сдавление проксимального отдела нижней полой вены;
- артериовенозные свищи (селезеночных или брыжеечных сосудов) и др.
По уровню блока портального кровотока:
- Подпеченочная (предпеченочная) — блок на уровне воротной вены и ее притоков:
- тотальная — захватывает весь бассейн воротной вены;
- сегментарная — ограничивается блокадой кровотока только по селезеночной вене. При этом кровоток по брыжеечным и воротной венам не нарушен, и давление в них остается нормальным.
- Внутрипеченочная (обусловленная патологией печени) — может быть:
- пресинусоидальная ПГ (болезнь Рандю – Ослера, врожденный фиброз печени, гранулематозы (шистосомоз, саркоидоз, туберкулез), хронический вирусный гепатит, первичный билиарный цирроз, болезнь Вильсона – Коновалова, поликистоз, а и др.);
- синусоидальная ПГ (цирроз печени, острый алкогольный гепатит, тяжелый вирусный гепатит и др.);
- постсинусоидальная ПГ (веноооклюзионная болезнь, алкогольный центрилобулярный гиалиновый склероз.)
Надпеченочная (постпеченочная):
- болезнь Киари (тромбоз печеночных вен);
- синдром Бадда – Киари (тромбоз нижней полой вены с облитерацией печеночных вен, мембрана в просвете нижней полой вены, инвазия опухолью);
- цирроз Пика сердечного происхождения (констриктивный перикардит, выраженная трикуспидальная регургитация).
- Смешанная (цирроз печени в сочетании с тромбозом воротной вены).
Осложнения портальной гипертензии:
- кровотечение из варикозно расширенных вен пищевода и желудка;
- гепатопорталъная энцефалопатия;
- асцит;
- гиперспленизм;
- вторичный геморрой;
- цирроз печени как исход болезни Киари;
- инфекционные осложнения: спонтанный бактериальный перитонит, инфекция мочевыводящих путей, пневмония, эмпиема плевры, эндокардит, менингит и др.
Этиология
Внутрипеченочная ПГ — наиболее часто встречающаяся форма, ее основная причина — цирроз печени. К другим (редким) причинам относят злокачественные опухоли, фиброз печени, гемохроматоз, альвеококкоз печени, шистозоматоз и др.
В патогенезе ПГ при циррозе печени основное значение имеет узловая регенерация, нарушающая дренажную функцию ветвей печеночных вен, что приводит к постсинусоидальной блокаде портального кровотока. В результате замещения паренхимы печени соединительной тканью (фиброза) происходит редукция внутрипеченочных разветвлений воротной вены, что на ангиограммах печени выглядит как «сухое дерево» (рисунок 3). Существенное значение в развитии портальной гипертензии при циррозе имеют образование артериовенозных сосудистых анастомозов (шунты между ветвями воротной вены и печеночной артерии), приводящие к повышению гидростатического давления в портальном русле и резкому снижению печеночного кровотока.
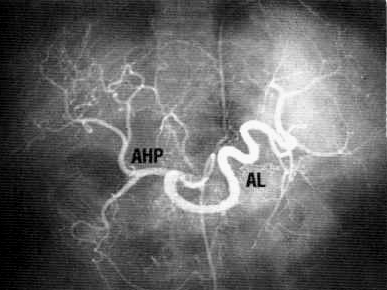
Рисунок 3 — Целиакограмма больного с циррозом печени: селезеночная артерия (AL) расширена в диаметре, извита, собственно печеночная артерия (АНР) сужена, ее внутрипеченочные ветви штопорообразно извиты, артериальный рисунок печени обеднен
Подпеченочная (предпеченочная) портальная гипертензия развивается в результате порока развития или тромбоза воротной вены. Аномалии воротной вены, как правило, проявляются в детском возрасте тем же клиническим синдромом, что и у взрослых. Однако нередко, протекая до какого-то времени бессимптомно, они проявляются уже во взрослом состоянии. Это может быть атрезия, гипоплазия или кавернозная трансформация воротной вены, а иногда и всей портальной системы, при этом шунтирующие портокавальные анастомозы зачастую невыполнимы.
Причины тромбоза воротной вены: воспалительные и опухолевые заболевания поджелудочной железы, злокачественные новообразования различной локализации, гемобластозы, тромбофилии и др.
Печень при этой форме ПГ мало отличается от нормальной, может быть уменьшена в размерах и более плотная. Цирротические изменения в ней не развиваются, и функция практически не нарушается. Длительное существование ПГ при пороке развития воротной вены приводит к значительному увеличению лимфообразования в органах брюшной полости и нарушению оттока лимфы из них с развитием лимфопортальной гипертензии. Клинически это выражается в увеличении числа и размеров лимфатических узлов в клетчатке брыжейки кишечника и забрюшинного пространства.
Сегментарную внепеченочную портальную гипертензию рассматривают как вариант внепеченочной формы. Причиной ее, как правило, являются воспалительные заболевания и опухоли поджелудочной железы, а также заболевания системы крови и тромбофилии. Основное отличие от тотальной внепеченочной гипертензии заключается в отсутствии варикозного расширения вен в пищеводе и обнаружение их в проксимальном отделе желудка.
Надпеченочную (запеченочную) форму портальной гипертензии относят к редким заболеваниям, причина которых не всегда ясна. Термином болезнь Киари обозначают симптомокомплекс, возникающий при нарушении оттока крови по печеночным венам. Наиболее частой причиной считается облитерирующий эндофлебит с тромбозом печеночных вен, впервые описанный венским патологоанатомом Гансом Киари. Развитие восходящего тромбоза в нижней полой вене с последующей облитерацией устьев печеночных вен называется синдромом Бадда – Киари. Он может развиться также в результате порока развития конечного отдела нижней полой вены (мембранозное заращение просвета нижней полой вены) либо сдавления ее опухолью или кистой. Вследствие длительно существующего синдрома или болезни Киари развивается цирроз печени как следствие застоя крови и гипоксии печени. Хронические заболевания сердца (недостаточность 3-створчатого клапана, констриктивный перикардит), сопровождающиеся правожелудочковой недостаточностью, в ряде случаев приводят к развитию цирроза Пика сердечного происхождения и ПГ.
Смешанная форма портальной гипертензии предполагает сочетание цирроза печени с тромбозом воротной вены, при этом уменьшение притока портальной крови к цирротически изменённой печени усугубляет течение основного заболевания, способствуя прогрессированию печёночной недостаточности и резистентного асцита.
Патогенез
Общим для всех форм портальной гипертензии является формирование следующих наиболее часто встречающихся симптомов заболевания: спленомегалии, варикозного расширения вен (ВРВ) пищевода и желудка и асцита.
Механизмы развития спленомегалии:
- нарушение оттока крови из селезенки;
- образование артерио-венозных шунтов, направленных на артеризацию крови в селезеночной вене;
- гиперплазия и гипертрофия ретикулоэндотелиальных элементов;
- гипоксия органа и разрастание соединительной ткани;
- застой лимфы с диффузией в окололимфатические пространства, в еще большей степени способствует пролиферации соединительной ткани в органе и его увеличению.
Нередко спленомегалию сопровождает цитопенический синдром: тромбоцитопения, лейкопения и анемия. Этот феномен получил название «гиперспленизм». В его патогенезе первостепенное значение придают повышенному депонированию и разрушению клеток крови в селезенке, а также ее тормозящему влиянию на костный мозг.
Механизмы развития и клиническое значение ВРВ пищевода и желудка
В условиях затруднения оттока по воротной вене раскрываются основные группы портокавальных анастомозов (см. выше). Для клиницистов наиболее важен гастроэзофагальный коллатеральный путь, предопределяющий основное направление хирургического лечения ПГ.
Повышенное портальное давление передается на функционирующие гастроэзофагеальные коллатерали, вызывая их дилатацию. Сначала вена равномерно стойко расширяется, удлиняется, что и обусловливает ее извитость (формируется флебэктазия). Варикозное расширение вен — дальнейшее развитие флебэктазии, при этом расширение становится неравномерным с узловыми мешковидными выпячиваниями стенок. ВРВ пищевода во многом способствует их окружение рыхлым подслизистым слоем, который не может быть препятствием для их эктазии и последующей варикозной трансформации.
Вторичный геморрой (варикозная трансформация геморроидальных вен) при портальной гипертензии является следствием образовавшихся портокавальных анастомозов в прямой кишке. Большое значение имеет несостоятельность коммуникантных вен, проходящих через мышечную стенку прямой кишки и связывающих портальную и кавальную системы в этой зоне. При отсутствии анастомозов между верхней, средней и нижней геморроидальными венами ПГ протекает без расширения вен прямой кишки. При надпеченочной (запеченочной) форме ПГ в коллатеральном кровотоке гораздо большее участие принимают вены брюшной стенки, в частности, пупочная вена, образуя мощное венозное сплетение «caput medusum». Появление выраженного расширения подкожных вен в области пупка свидетельствует о незаращении и функционировании пупочной вены (синдром Крювелье – Баумгартена). Гастроэзофагеальный коллатеральный кровоток у этих пациентов, как правило, выражен в меньшей степени.
Риск возникновения кровотечения из ВРВ пищевода и желудка зависит от степени варикозной венозной трансформации. В то же время даже значительное повышение портального давления не может вызвать перфорацию вены и кровотечение. Разрыву венозной стенки предшествуют трофические расстройства и эрозии слизистой оболочки, покрывающей вены, в результате обнажается участок оголенной стенки варикозной вены. Это так называемые «красные знаки» (red signs) — предикторы геморрагии, выявляемые при ФЭГДС.
При затруднении оттока крови из пищевода при ПГ снижается тонус, и нарушается моторика пищевода и развивается его дилатация, что приводит к еще большему затруднению оттока крови из варикозных вен, усугублению течение эрозивного процесса в слизистой оболочке и угрозе перфорации венозной стенки. Начавшееся кровотечение усиливает трофические расстройства в слизистой оболочке пищевода и желудка, что в свою очередь приводит к образованию новых эрозий и повторному кровотечению при колебаниях портального давления.
Пусковым моментом разрыва варикозно изменённой венозной стенки чаще всего является портальный гипертонический криз, причинами которого могут быть: увеличение артериального и портального притока крови к желудку и пищеводу после обильного приема пищи; физические нагрузки, контрастное исследование портальной системы, резкие колебания атмосферного давления. Также причиной кровотечения может быть механическое повреждение вен при глотании плохо прожеванной плотной пищи или при рвотных движениях пациента во время ФЭГДС. Сердечная недостаточность, приводящая к ПГ в системе непарной вены, невозможность спадения стенок варикозно измененной вены пищевода вследствие склероза паравазальной клетчатки, локального нарушения гемокоагуляции объясняют продолжительность геморрагии из варикозных вен пищевода и желудка.
В патогенезе пищеводно-желудочных кровотечений в последние годы большое значение придают так называемой гастропатии, ассоциированной с ПГ. Она проявляется значительным увеличением числа подслизистых артериовенозных анастомозов, дилатированных прекапилляров, капилляров и вен. Отмечается утолщение стенок артериол, подслизистый
отек и экстравазация эритроцитов через дефекты эндотелия в межэпителиальном пространстве. Кровотечение при гипертензионной портальной гастропатии протекающим скрытно, иногда оно может быть массивным, угрожающим жизни больного. Однако гастропатия, ассоциированная с ПГ имеет динамическое состояние. Со временем она может появляться заново, уменьшаться и даже полностью исчезнуть.
Причины развития асцита
Патогенез асцита сложен. В его происхождении участвует несколько факторов:
- блок оттока крови из печени при надпеченочной ПГ приводит к динамической недостаточности лимфообращения и «пропотеванию» жидкости с поверхности печени в брюшную полость;
- повышение гидростатического давления крови в портальных сосудах при ПГ;
- гипоальбуминемия вследствие недостаточности белково-синтетической функции печени при циррозе, а также после массивной кровопотери, приводящие к снижению коллоидно-осмотического давления плазмы крови и транссудации жидкости в области венозного стаза;
- гиперальдостеронизм вследствие повышенной секреции альдостерона корой надпочечников и уменьшенной инактивации гормона в гепатоцитах при печеночноклеточной недостаточности на фоне цирроза. Избыточно выделяющийся альдостерон приводит к задержке натрия и жидкости.
- электролитные расстройства (гипернатриемия, гипокалиемия).
Диагностика портальной гипертензии
Диагностика ПГ должна быть комплексной и направлена на установление основного заболевания (причины ПГ), непосредственно ПГ и ее осложнений. Диагностика включает клиническое обследование, лабораторные тесты и инструментальные методы.
Клиническое обследование
У пациента с заболеванием печени о развитии портальной гипертензии свидетельствуют следующие клинические признаки: спленомегалия, асцит, печеночная энцефалопатия и ВРВ пищевода и желудка. И, наоборот, при выявлении любого из этих симптомов необходимо исключить ПГ и цирроз печени.
Проявления различных видов ПГ клинически схожи, но выраженность того или иного симптома во многом зависит от причины заболевания. Так, при внутрипеченочной ПГ клинические проявления в значительной степени
определяются тяжестью цирроза печени. В стадии компенсации пациенты могут не предъявлять жалоб; в стадии суб- и особенно декомпенсации появляются нарастающая слабость, быстрая утомляемость, головная боль, сонливость, иногда беспокоят боли в области печени и селезенки, расстройства пищеварения, метеоризм, отрыжка, потеря аппетита, снижение массы тела и др.
Симптомы обусловлены:
- поражением печени (желтуха, энцефалопатия, печеночно-клеточная недостаточность, асцит, анемии, отеки и т.д.);
- гиперэстрогенемией вследствие нарушенного разрушения эстрогенов в печени («сосудистые звездочки», пальпарная эритема, пекторальная алопеция, гинекомастия, атрофия яичек и др.);
- эффектами портальной гипертензии (ВРВ пищевода и желудка, «голова медузы», вторичный геморрой, асцит, спленомегалия, гиперспленизм).
Наиболее частой причиной ПГ является цирроз печени, следовательно, важно оценить компенсаторные возможности органа для выбора адекватного варианта лечебных мероприятий. Наиболее удобной с практической точки зрения считается балльная оценка тяжести и классификация цирроза печени по Чайлду – Пью (таблица 1), позволяющая разделить пациентов на три функциональных класса:
- класс «А» (цирроз печени в стадии функциональной компенсации) – 5–7 баллов;
- класс «В» (субкомпенсированная стадия) — 8–10 баллов;
- класс «С» (декомпенсированная стадия) — более 10 баллов.
При функциональных классах цирроза печени «А» и «В» возможно проведение хирургического вмешательства, при декомпенсированном циррозе печени (класс «С») риск операции предельно высок, преимущество отдают консервативным или «малоинвазивным» методам лечения.
Таблица 1 — Бальная оценка тяжести цирроза печени
| Критерии оценки | Количество баллов | ||
| 1 | 2 | 3 | |
| Асцит | Отсутствует | Небольшой | Большой |
| Степень энцефалопатии | Нет | 1–2 | 3–4 |
| Билирубин (моль/л) | < 34 | 34–51 | > 51 |
| Альбумин (г/л) | > 35 | 28–35 | < 28 |
| Протромбиновый индекс (%) | > 70 | 50–70 | < 50 |
У пациентов с внутрипеченочной ПГ на ранних стадиях гепатита печень увеличена в размерах, в дальнейшем при прогрессировании фиброза и цирроза печень уменьшается в размерах (чаще после перенесенного вирусного гепатита). Нередко наблюдают гипертрофию только левой доли печени, иногда занимающей всю эпигастральную область. При пальпации край печени плотный, бугристый. Гепатомегалию, как правило, отмечают при алкогольном и билиарном циррозе.
Спленомегалия — обязательный симптом ПГ. При пальпации нижний край селезенки, как правило, выступает из-под реберной дуги на 4–5 см, тугоэластической консистенции, безболезненный. Иногда спленомегалия сопровождается острыми или тупыми болями в левом подреберье и грудной клетке слева, что может быть связано с периспленитом или инфарктом селезенки. Нередко развивается клиника гиперспленизма, проявляющаяся выраженной панцитопенией с геморрагическим синдромом в виде носовых, десневых кровотечений, кровоподтеков на коже, появляющихся после незначительных травм.
Асцит развивается на поздних стадиях заболевания и считается признаком декомпенсации патологического процесса в печени. Характеризуется симметричным увеличением живота, растяжением пупочного кольца и выбуханием пупка, притупление перкуторного звука в отлогих местах. На начальных стадиях он транзиторный, легко поддается медикаментозному лечению. В последующем асцит становится резистентным к консервативной диуретической терапии, проявляется клиникой «напряженного» асцита с явлениями дыхательной и сердечно-сосудистой недостаточности, что требует проведения лапароцентезов. Это приводит к быстрому истощению больных, при инфицировании транссудата — развитию асцитперитонита и нередко летальному исходу. Иногда транзиторный асцит возникает после профузного кровотечения.
В практической работе удобна классификация Международного общества по изучению асцита, которая включает 3 степени асцита:
- 1 степень — жидкость в брюшной полости определяется только при ультразвуковом исследовании (УЗИ);
- 2 степень проявляется симметричным увеличением живота;
- 3 степень — напряженный асцит (сопровождается симптомами дыхательной и сердечно-сосудистой недостаточности).
Если адекватная мочегонная терапия при соблюдении диеты в течение 1 недели не приводит к уменьшению асцита, то его называют резистентным, что встречается у 10 % пациентов с циррозом печени. Выживаемость таких пациентов в течение 1 года, как правило, не превышает 50 %.
Варикозное расширение вен пищевода и желудка выявляют примерно у половины пациентов с циррозом печени. Частота их появления коррелирует с тяжестью цирроза печени (выявляется у 40 % пациентов при классе A и у 85 % — при классе С). Частота развития составляет примерно 8 % в год, при этом наиболее значимым прогностическим фактором является печеночно-венозный градиент давления, превышающий 10 мм рт. ст. Примерно с такой же частотой происходит переход так называемых мелких вен в крупные. Главными факторами риска увеличения размера варикозного узла являются цирроз класса B или C, алкогольный генез цирроза, наличие так называемых «красных рубцов» (напоминающие следы от ударов плетью продольно расположенные расширенные венулы).
Кровотечения из варикозных вен пищевода и желудка часто бывают обильными, сопровождаются рвотой по типу срыгивания неизмененной кровью и сгустками крови часто без предшествующей тошноты, меленой, а также общими симптомами кровопотери (тахикардия, артериальная гипотензия, бледность и потливость кожных покровов). Они склонны к рецидивам и являются основной причиной смерти таких пациентов. Как правило, кровотечения приводят к значительному ухудшению функции печени, что может сопровождаться нарастающей желтухой, асцитом, прогрессирующей энцефалопатией.
Гепатопорталъная энцефалопатия у больных циррозом печени провоцируется после употребления белковой пищи животного происхождения, приема некоторых седативных препаратов и диуретиков, при инфекционных заболеваниях, сопровождающихся лихорадкой, после портокавального шунтирования, эпизодов пищеводно-желудочных кровотечений. По клиническим критериям выделяют 4 степени тяжести острой энцефалопатии:
- степень — сонливость, умеренно выраженные эмоциональные нарушения и тремор пальцев и кистей («флеппинг»-симптом) при сохранении ориентировки в месте и времени;
- степень — дезориентировка в месте и времени при возможности вербального контакта с пациентом;
- степень — вербальный контакт невозможен, но сохранена адекватная защитная реакция на болевое раздражение;
- степень — реакция на боль отсутствует или имеет неадекватный характер в виде судорог.
Внепеченочные формы ПГ также имеют свои характерные клинические особенности. Первым клиническим проявлением тотальной подпеченочной портальной гипертензии могут быть либо случайно обнаруженная спленомегалия, либо внезапно возникшее кровотечение из ВРВ пищевода и желудка на фоне полного здоровья. При этом в анамнезе отсутствуют указания на печеночную патологию. Печень нормальных размеров или бывает уменьшена, отсутствует желтуха и энцефалопатия. Асцит наблюдают редко, свидетельствует о тотальном поражении вен портальной системы. Иногда транзиторный асцит возникает после профузного кровотечения. Гиперспленизм при этой форме ПГ наблюдается значительно реже, чем при циррозе печени.
Для надпеченочной ПГ характерны: значительная гепатомегалия и быстро прогрессирующий асцит. Заболевание развивается остро с жалоб на боль и чувство тяжести в области печени и быстрое увеличение живота. Спленомегалия и варикозные вены пищевода и желудка появляются значительно позже по мере хронизации патологического процесса. Для острого периода характерны полицитоз, высокие цифры гемоглобина и гематокрита вследствие гемоконцентрации из-за пропотевания жидкой части крови в брюшную полость. При острой форме болезни Киари быстро прогрессирует печеночная недостаточность, что может привести к летальному исходу в течение нескольких недель в случае промедления с интенсивной тромболитической и антикоагулянтной терапией.
При синдроме Бадда – Киари развивается выраженное расширение подкожных вен брюшной стенки, начиная от паховых складок и распространяясь по переднебоковым стенкам живота и грудной клетки. Причиной данного симптома является раскрытие естественных кавакавальных анастомозов вследствие вовлечения в патологический процесс не только печеночных вен, но и нижней полой вены.
Тромбофилия, подтвержденная результатами коагулограммы, может стать причиной вторичной внепеченочной ПГ, что нужно учитывать при лечении пациентов.
При сегментарной подпеченочной ПГ клиническая картина, как правило, ограничивается спленомегалией и ВРВ кардиального отдела желудка с эпизодами профузных кровотечений. В анамнезе у большинства пациентов есть указания на перенесенный панкреатит. Биохимические тесты и анализы периферической крови, как правило, находятся в пределах нормы.
Лабораторная диагностика
Степень функциональной компенсации у пациентов с циррозом печени определяют по Чайлду-Пью (см. выше). В биохимическом анализе крови пациентов с циррозом печени необходимо определять следующие показатели: аланинаминотрансферазу (АлАТ), аспартатаминотрансферазу (АсАТ), щелочную фосфатазу (ЩФ), гамма-глутамилтранспептидазу (ГГТП), билирубин, альбумин, калий, натрий, креатинин. Необходимо оценить уровень активности воспалительного процесса печени. Наибольшее значение придается уровню аминотрансфераз (ACT и АЛТ), которые считают чувствительным индикатором повреждения клеток печени. Значительное их повышение (в 3–4 раза и выше) в сочетании с гипергаммаглобулинемией, повышением СОЭ и уровня билирубина свидетельствует о высокой активности патологического процесса в цирротической печени и высоком риске хирургического вмешательства. Морфологическая оценка степени активности цирроза печени путем проведения тонкоигольной трепанбиопсии, как правило, совпадает с оценкой биохимических тестов.
При компенсированном циррозе печени активность печеночных ферментов может быть нормальной. Существенное повышение АлАТ, АсАТ, ГГТП наблюдается при алкогольном гепатите с исходом в цирроз, а резкое повышение ЩФ — при первичном билиарном циррозе. Кроме того, у больных циррозом печени повышается общий билирубин, снижается содержание альбумина. Содержание аминотрансфераз в терминальной стадии цирроза печени всегда снижается (нет функционирующих гепатоцитов).
Показатели неблагоприятного прогноза: билирубин выше 300 мкмоль/л; альбумин ниже 20 г/л; протромбиновый индекс менее 60 %.
У пациентов с отечно-асцитическим синдромом необходимо определять содержание в крови электролитов, альбумина, мочевины, креатинина.
У пациентов с циррозом печени наблюдается уменьшение количества тромбоцитов. На поздних стадиях при спленомегалии с гиперспленизмом в общем анализе крови наблюдается панцитопения (анемия, лейкопения, тромбоцитопения). Следует помнить, что при миелопролиферативных заболеваниях и тромбофилии также наблюдается спленомегалия. При этом, селезенка достигает больших размеров, нижний полюс которой на 10–15 см ниже реберной дуги и иногда достигает уровня крыла подвздошной кости, на фоне нормальных биохимигеских параметров крови, а число тромбоцитов и лейкоцитов в периферической крови повышается в 1,5 и более раз.
Следствием пищеводных кровотечений является постгеморрагическая анемия со снижением в общем анализе крови числа эритроцитов, уровня гемоглобина и гематокрита.
Для пациентов с гемохроматозом характерно сочетание высокого содержания гемоглобина с низкими показателями концентрации гемоглобина в эритроцитах.
При анализе коагулограммы у пациентов с циррозом печени наблюдается снижение протромбинового индекса (отношение стандартного протромбинового времени к протромбиновому времени у обследуемого пациента, выраженное в процентах). Протромбиновое время отражает время свертывания плазмы после добавления тромбопластин-кальциевой смеси. В норме этот показатель составляет 11–20 с и во многом зависит от активности тканевого тромбопластина, использованного при исследовании.
Необходимо исследовать антитела к вирусам, вызывающим хрони- ческие вирусные гепатиты В и С, даже если цирроз печени имеет прямую связь с хронической алкогольной интоксикацией.
Повышенный уровень сывороточных IgA, IgM, IgG часто выявляется при алкогольных поражениях печени, первичном билиарном циррозе печени и при аутоиммунных болезнях.
При циррозе печени имеет значение определение параметров, характеризующих почечную функцию (белок, лейкоциты, эритроциты, креатинин, мочевая кислота). У пациентов с отечно-асцитическим синдромом необходимо определять суточный диурез.
Инструментальная диагностика
Изучение жалоб пациента, анамнеза, клинических проявлений позволяют не только диагностировать ПГ, но вероятностно определить ее форму. Однако окончательная верификация диагноза и выбор метода операции возможны только после проведения инструментальных методов диагностики. Эзофагогастродуоденоскопия является «золотым стандартом» диагностики ВРВ пищевода и желудка, как основного признака ПГ. ФЭГДС позволяет определить локализацию ВРВ, оценить степень их расширения, состояние стенки вены и слизистой оболочки пищевода и желудка, выявить сопутствующую патологию и угрозу кровотечения.
Классификация ВРВ пищевода и желудка По размерам (А. Г. Шерцингер, 1986):
- I степень — вены диаметром до 3 мм;
- II степень — от 3 до 5 мм;
- III степень — более 5 мм.
I и II — малые вены, III — большие (рисунок 4).
По эндоскопической картине:
- степень — минимальное расширение вен над поверхностью слизистой оболочки — единичные вены, уменьшающиеся при надавливании на них эндоскопом;
- степень — извилистые вены занимают менее трети просвета пищевода — несколько столбов вен, не сливающихся по окружности пищевода, но не уменьшающихся при надавливании на них эндоскопом;
- степень — ВРВ занимают более трети просвета пищевода или сливаются по всей окружности пищевода.
По локализации:
- изолированный варикоз пищевода;
- ВРВ пищевода с распространением на кардиальный и субкардиальный отделы желудка;
- изолированное ВРВ проксимального отдела желудка. Эндоскопическое исследование позволяет также выявить признаки угрозы пищеводно-желудочного кровотечения:
- ВРВ пищевода и желудка III степени;
- напряжение узлов;
- истончение стенки варикозных вен;
- «красные маркеры» на слизистой оболочке — васкулопатии;
- дилатация пищевода.
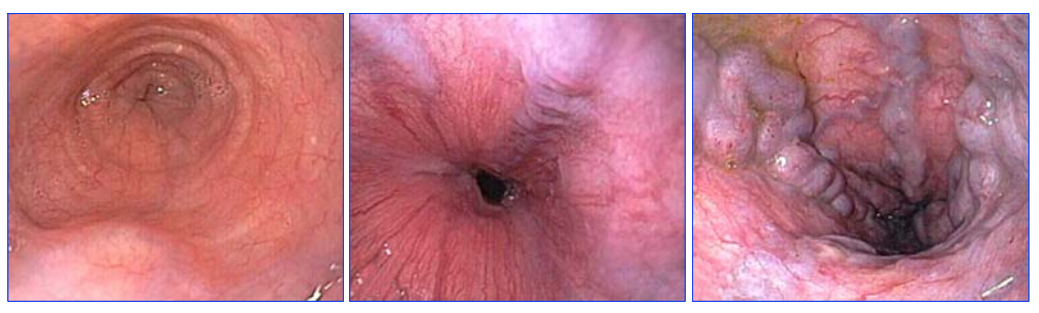
Рисунок 4 — Фиброэзофагоскопия: слева — норма, малые (в центре) и большие (справа) ВРВ пищевода
ФЭГДС позволяет также выявить гастропатию, ассоциированную с портальной гипертензией, — макроскопические изменения слизистой оболочки желудка, связанные с эктазией и дилатацией сосудов слизистого и подслизистого слоя без значительных воспалительных изменений. Согласно классификации Североитальянского эндоскопического клуба (NIEC), опубликованной в 2005 г., выделяют 2 степени гастропатии:
- I (легкая) — проявляется мозаичным рисунком слизистой оболочки желудка;
- II (тяжелая) — характеризуется возникновением вишневых или чернокоричневых пятен, обусловленных кровоизлияниями в слизистую оболочку.
Рентгенологическое исследование. Обзорная рентгенограмма живота может напоминать матовое стекло из-за асцита и увеличенной селезенки. Контрастная рентгенография пищевода и желудка позволяет выявить ВРВ, которые обычно распознаются по специфическому внешнему виду слизистой, на которой при глотке бария выявляются извитые, червеобразные сосуды (рисунок 5).
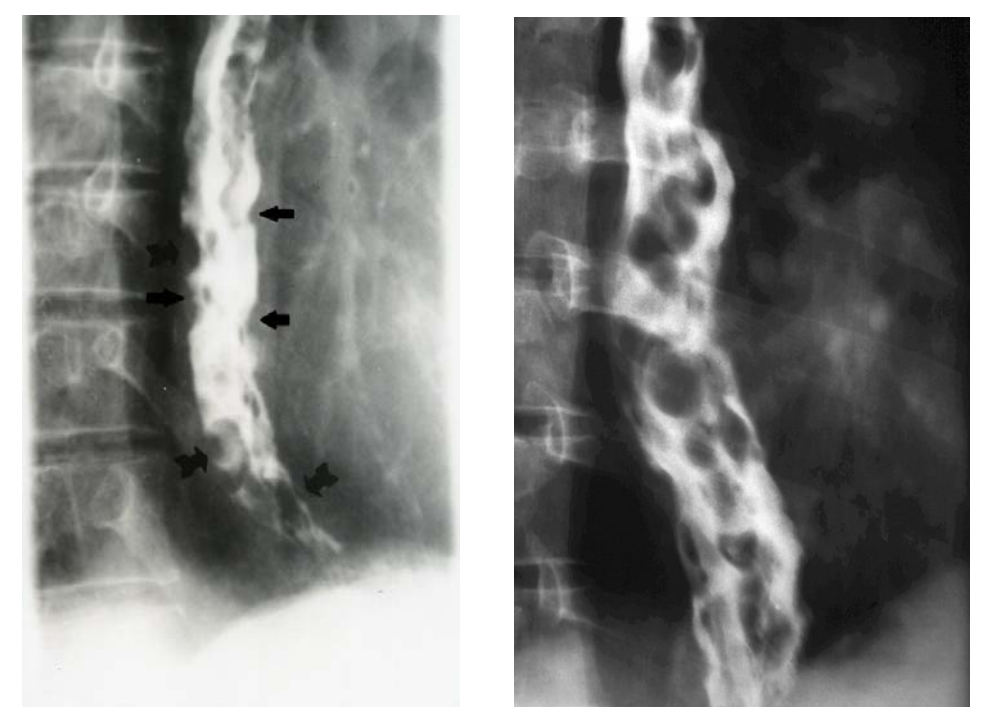
Рисунок 5 — Контрастная рентгенография пищевода: ВРВ в средней и нижней трети пищевода
УЗИ брюшной полости помогает определить предполагаемую форму портальной гипертензии, выявить асцит, патологически измененную плотность и структуру печени, увеличенную селезенку, расширенные портальные вены и коллатерали и позволяет оценить возможность выполнения шунтирующей операции (рисунок 6). С помощью допплеровского УЗИ можно определить кровоток, проходимость и калибр воротной вены и ее ветвей.
При сегментарной подпеченочной ПГ на фоне тромбоза селезеночной вены кровоток в ней не определяется, а в воротной вене, как правило, не изменен. В таких случаях всегда присутствует спленомегалия. Может быть обнаружена киста или опухоль в области хвоста поджелудочной железы как причина сегментарной ПГ. У пациентов с надпеченочной формой ПГ при проведении УЗИ обязательно оценивают диаметр и проходимость нижней полой вены на уровне печеночных вен: при болезни Киари она проходима, при синдроме Бадда – Киари — нет.
УЗИ признаки портальной гипертензии:
- увеличение диаметра воротной, селезеночной вен и недостаточное расширение воротной вены во время вдоха. Диаметр воротной вены на выдохе в норме не превышает 10 мм, на вдохе — 12 мм. Если диаметр воротной вены больше 13 мм на выдохе и почти не реагирует увеличением диаметра на вдохе, то это указывает на ПГ. Диаметр селезеночной вены на выдохе в норме до 5–8 мм, на вдохе — до 10 мм. Расширение диаметра селезеночной вены более 10 мм — достоверный признак ПГ;
- увеличение диаметра верхней брыжеечной вены; в норме диаметр ее на вдохе до 10 мм, на выдохе — до 2–6 мм;
- снижение скорости кровотока в воротной вене или ретроградный кровоток;
- реканализация пупочной вены;
- появление расширенных порто-кавальных анастомозов.
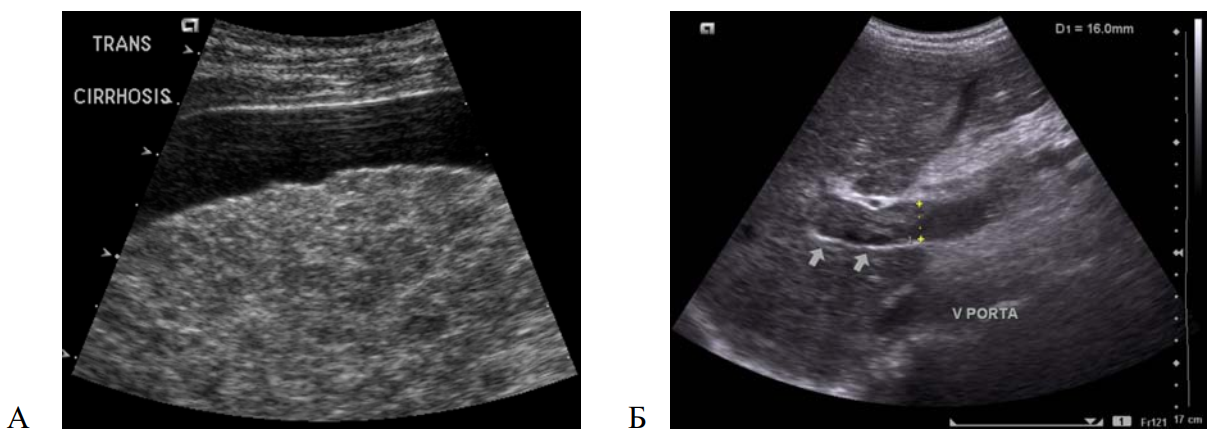
Рисунок 6 — УЗИ печени и воротной вены: А — цирроз печени (бугристый край, узловая перестройка паренхимы, асцит); Б — тромбоз воротной вены (неоднородное образование повышенной эхогенности с неровными, нечеткими контурами в просвете расширенной до 16 мм воротной вены)
С помощью КТ-сканирования (компьютерная спиральная томограмма с внутривенным болюсным усилением) брюшной полости можно идентифицировать цирроз или другие поражения печени, патологию сосудов, расширение воротной вены и порто-кавальных анастомозов (рисунок 7).
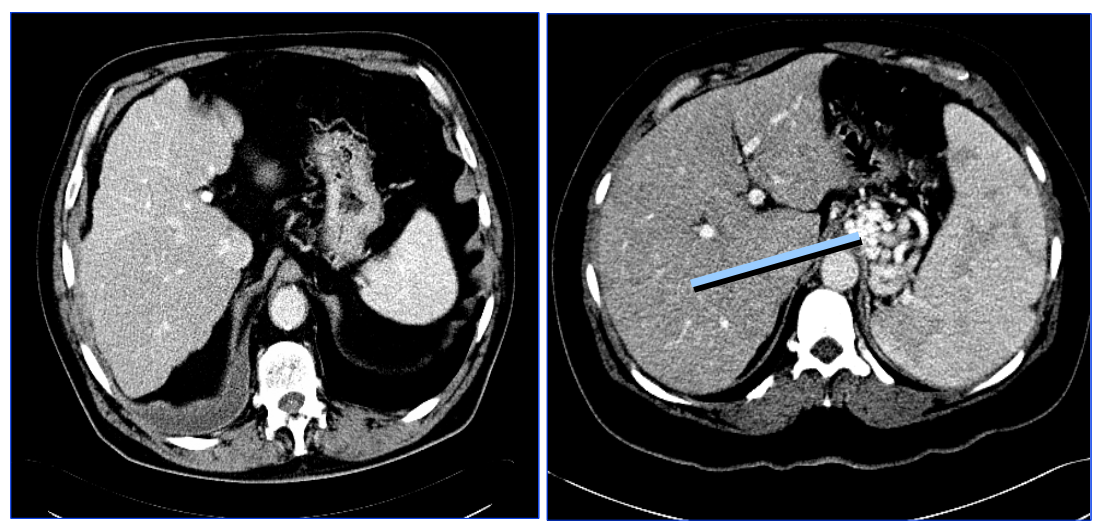
Рисунок 7 — Компьютерная томография при ПГ: слева — картина цирроза печени, асцит; справа — спленомегалия, варикозное расширение анастомозов
Несмотря на высокую информативность современных методов УЗИ и КТ для диагностики ПГ в некоторых случаях необходимо измерение давления в системе воротной вены и ангиографигеское исследование портальной системы, особенно при выборе тактики хирургического вмешательства и оценке его эффективности.
Для измерения давления в системе воротной вены предложено несколько способов:
- Гепатоманометрия выполняется после пункции печени, независимо от положения иглы в печени давление около синусоидов отражает давление в портальной системе. Внутрипеченочное давление в норме составляет 80–130 мм вод. ст., при циррозе печени возрастает в 3–4 раза.
- Спленоманометрия — измерение давления в селезеночной пульпе (точно отражает давление в селезеночных венах) после чрескожной пункции селезенки специальной иглой, соединенной с водным манометром. В норме давление не превышает 120–150 мм вод. ст.
- Портоманометрия — непосредственное измерение давления в воротной вене. Технически реализуется путем чрескожной чреспеченочной пункции воротной вены под УЗ- и рентгенологическим контролем Ее также можно произвести во время лапаротомии, а также после пункции бужированной пупочной вены и проведения катетера в воротную вену (трансумбиликальная портография). Условно выделяют портальную гипертензию умеренно выраженную (портальное давление 150-300 мм вод. ст.) и резко выраженную (портальное давление выше 300 мм вод. ст.).
Общим недостатком всех этих методов является отсутствие четкого нулевого уровня, оцениваемого по уровню правого предсердия. Кроме того, пункция паренхимы печени или селезенки влечет за собой риск кровотечения (1–3 %).
- Определение давления заклинивания в печеночной вене (ДЗПВ). Катетеризация печеночной вены с помощью баллонного катетера осуществляется через яремную или бедренную вены. При заклинивании катетера в небольшой ветви печеночной вены определяемое давление практически равно давлению в воротной вене. Когда кончик катетера лежит в печеночной вене свободно, измеряемое при этом свободное давление в норме должно быть на 1–4 мм рт. ст. меньше, чем ДЗПВ. Разница между ДЗПВ и свободным давлением в печеночной вене известна как градиент печеночного венозного давления (портогепатической градиент). ДЗПВ повышается при синусоидальной (в том числе при циррозе печени) и постсинусоидальной ПГ, но не изменяется при пресинусоидальной ПГ.
- Каваманометрия — измерение давления крови в нижней полой вене (в норме 80–100 мм вод. ст.). При сдавлении нижней полой вены (синдром Бадда – Киари) давление в ней возрастает свыше 200 мм вод. ст.
Методы контрастирования портальной системы позволяют визуализировать воротную систему, идентифицировать венозную окклюзию и коллатеральный кровоток:
- Спленопортография выполняется после спленоманометрии, через катетер в селезенку вводится контрастное вещество. Спленопортография дает представление о состоянии сплено-портального русла: его проходимости, диаметре вен, расширении портокавальных анастомозов. При внутрипеченочном блоке на спленопортограмме видны лишь основные стволы ветвления воротной вены. При внепеченочном блоке спленопортография позволяет установить его уровень (рисунок 8).
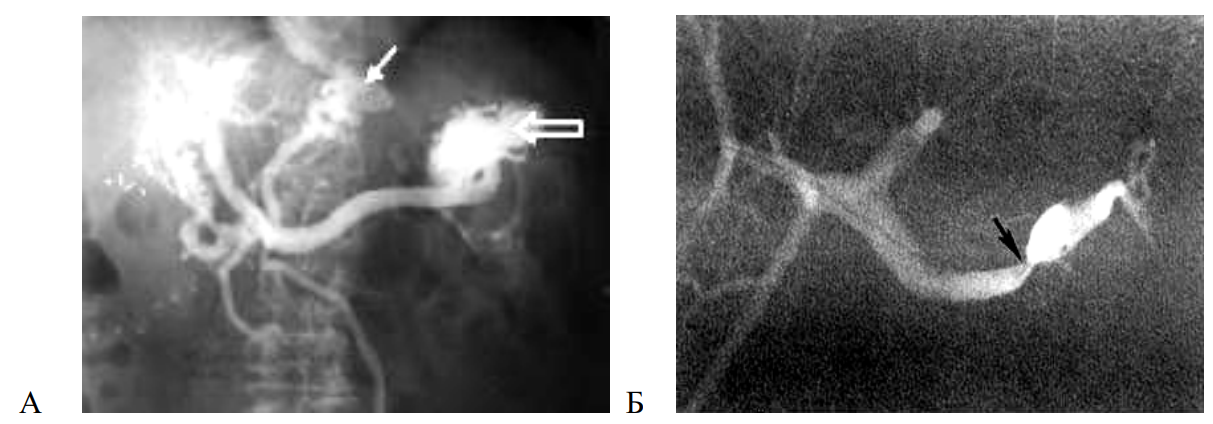
Рисунок 8 — Спленопортограмма: А — ПГ на фоне цирроза печени (расширение селезеночной вены, большой стрелкой указана контрастированная селезенка, малой — ВРВ пищевода); Б — сегментарная ПГ на фона стеноза селезеночной вены (указана стрелкой)
- Портогапатография — через катетер в портальную вену вводится контрастное вещество для оценки состояния сосудистого русла и наличии внутрипеченочного блока.
- Мезентерикография: прямая (интраоперационно через катетер, введенный в ветвь верхней брыжеечной вены), непрямая (возвратная — венозная фаза артериографии).
- Гепатовенография и кавография (сочетают с каваманометрией) — контрастирование печеночных вен и нижней полой вены — имеют решающее значение в распознавании синдрома Бадда – Киари.
Контрастная 3D магнитно-резонансная портография — неинвазивная высокоинформативная, но дорогостоящая методика (рисунок 9).
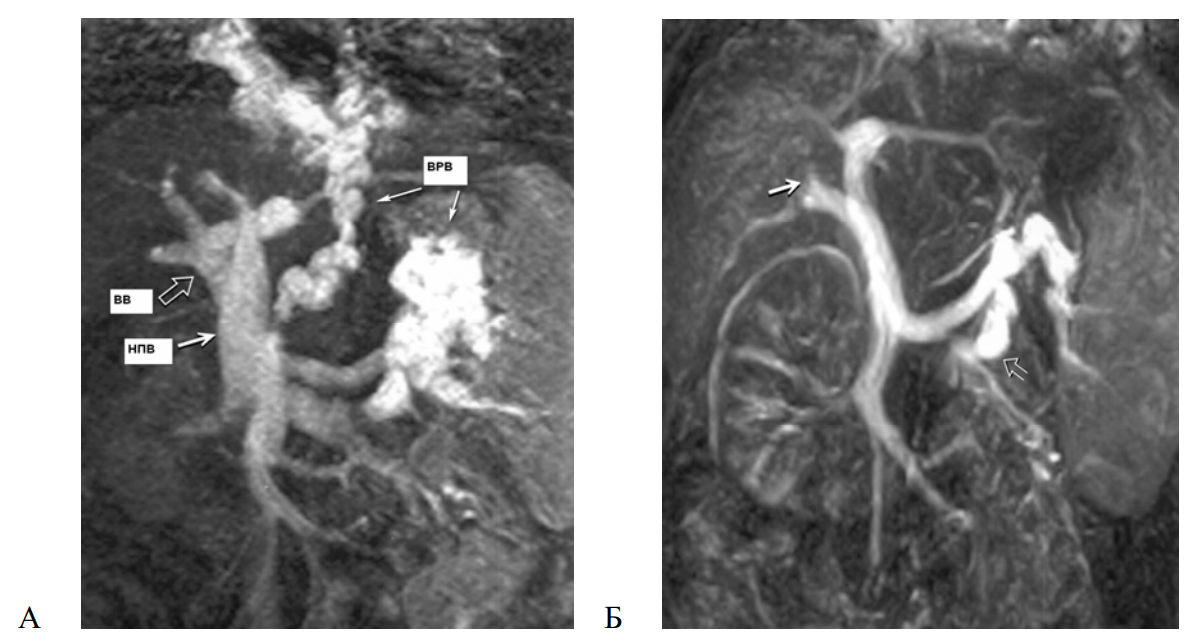
Рисунок 9 – Контрастная 3D магнитно-резонансная портография:А — ПГ при циррозе печени (ВВ — воротная вена, НПВ — нижняя полая вена, ВРВ кардии желудка и пищевода); Б — ПГ на фоне сдавления опухолью печени правой долевой воротной вены (указана стрелкой)
Радиоизотопное сканирование печени часто выявляет неоднородное «пятнистое» поглощение изотопов печенью в сочетании с увеличенным поглощением их костным мозгом и селезенкой.
Дифференциальная диагностика
При эндоскопическом обнаружении ВРВ пищевода и желудка диагноз портальной гипертензии не вызывает сомнений. Различные формы ПГ вызываются определенными заболеваниями, которые, как правило, имеют свою клиническую картину. Однако в некоторых случаях пациенты поступают в стационар с предварительным диагнозом «асцит неясной этиологии», когда ПГ приходится дифференцировать с констриктивным перикардитом, туберкулезным поражением или канцероматозом брюшины.
При констриктивном перикардите быстро развиваются набухание шейных вен и цианоз кожных покровов головы и шеи при переводе пациента из вертикального в горизонтальное положение. При аускультации сердца отмечается приглушение сердечных тонов, при ФЭГДС — отсутствие ВРВ в пищеводе и желудке. Селезенка не увеличена. А печень значительно увеличена, плотная, умеренно болезненная при пальпации. Однако функциональные печеночные тесты остаются в норме. В постановке диагноза помогает эхокардиография.
В случаях асцита при канцероматозе и туберкулезе брюшины во время диагностической лапароскопии видны множественные белесоватые бугорки, располагающиеся на висцеральной и париетальной брюшине. Цитологическое и микробиологическое исследование асцитической жидкости, а также биопсия с морфологическим исследованием очагов на брюшине позволяют подтвердить диагноз.
Имитировать асцит у женщин могут большие кисты придатков матки, объем которых может достигать более 10 л. Визуально живот мало отличается от асцитического. Пальпация брюшной стенки при кисте дает ощущение упругости и некоторое западение контура брюшной стенки в эпигастральной области, а при большом асците цирротического генеза живот мягкоэластической консистенции, часто сопровождается растяжением пупочного кольца. Отсутствие спленомегалии и ВРВ в пищеводе и желудке позволяет исключить диагноз ПГ, а последующие УЗИ или КТ брюшной полости — поставить правильный диагноз.
Спленомегалия является симптомом многих заболеваний системы крови (болезнь Гоше, гемолитическая анемия, хронический миелолейкоз и др.). Отсутствие ВРВ в пищеводе и желудке, полностью проходимое спленопортальное русло с нормальными диаметрами сосудов по данным УЗИ, а также характерные изменения в анализе крови дают возможность избежать диагностической ошибки. Необходима консультация гематолога.
Примеры формулировки диагноза
На основании данных проведенного обследования формируется заключительный диагноз, при этом, указываются основное заболевание, послужившее причиной ПГ, форму ПГ и ее основной симптом, который обосновывает операцию или другое вмешательство. Так, если в качестве причины ПГ выступает цирроз печени, то следует указать стадию заболевания и уровень активности процесса. Например: «Цирроз печени, компенсированный (группа «А»), неактивный, внутрипеченочная портальная гипертензия, варикозное расширение вен пищевода и желудка III степени с явлением эрозивного эзофагита и высоким риском кровотечения, гастропатия тяжелой степени».
Если выявляется хронический панкреатит и киста в области хвоста железы, то диагноз формулируют так: «Хронический панкреатит, киста хвоста поджелудочной железы, вторичная сегментарная внепеченочная портальная гипертензия, варикозное расширение вен проксимального отдела желудка с рецидивами желудочных кровотечений в анамнезе».
В тех случаях, когда причиной ПГ является порок развития воротной вены, диагноз формулируют следующим образом: «Первичная тотальная внепеченочная портальная гипертензия, варикозное расширение вен пищевода и желудка III степени с явлением эзофагита и рецидивами кровотечений». Если ранее у такого больного была удалена селезенка, то к диагнозу добавляют «состояние после спленэктомии», что ориентирует хирурга на невозможность использования селезеночной вены для портокавального шунта.
При болезни Киари и синдроме Бадда – Киари диагноз формулируют как: «Болезнь Киари (или синдром Бадда – Киари), надпеченочная портальная гипертензия, диуретикорезистентный асцит, варикозное расширение вен пищевода и желудка I степени». В данном случае следует указать состояние варикозных вен пищевода и желудка, которые не угрожают больному кровотечением. Следовательно, можно обсуждать вопрос об операции перитонеовенозного шунтирования или лимфовенозного анастомоза.
Лечение портальной гипертензии
Стратегия лечебных мероприятий
Самым клинически значимым хирургическим осложнением портальной гипертензии является ВРВ пищевода и желудка с кровотечением или угрозой кровотечения из них, что требует активного (чаще всего хирургического) лечения, так как каждый рецидив кровотечения, вместе с непосредственной угрозой жизни пациенту, приводит к значительному ухудшению функции печени, нередко к развитию печеночной недостаточности, энцефалопатии и асциту.
В современной практике существуют три принципиальных подхода к лечению и профилактике кровотечений из ВРВ пищевода и желудка.
Первый подход предполагает декомпрессию портальной системы путем портокавального шунтирования (ПКШ). Для этого используют различные виды сосудистых портокавальных анастомозов, включая трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS — transjugular intrahepatic portosystemic shunt).
Второй подход заключается в разобщении портокавальных анастомозов в зоне пищевода и желудка с помощью различных хирургических операций: деваскуляризация пищевода и желудка, транссекция пищевода, прошивание и перевязка вен в кардиоэзофагальной области, резекция пищевода и желудка, а также современные «малоинвазивные» вмешательства (эндоскопическое склерозирование или лигирование ВРВ, эндоваскулярная эмболизация левой желудочной вены и коротких вен желудка).
Третий состоит в консервативном снижении портального давления с помощью лекарственных препаратов (β-адреноблокаторы, нитраты, вазопрессоры). Однако сохраняется высокий градиент давления между портальной и кавальной системой.
Указанные выше методы лечения носят паллиативный симптоматический характер: направлены не на лечение основного заболевания, а на ликвидацию одного из основных осложнений портальной гипертензии — кровотечений из ВРВ пищевода и желудка. Единственный радикальный метод хирургического лечения ПГ у пациентов с терминальной стадией цирроза печени — трансплантация.
Показания к хирургическому лечению портальной гипертензии. предоперационная подготовка
Основным показанием к хирургическому вмешательству при ПГ является кровотечение из ВРВ пищевода и желудка как главная причина летального исхода. Профилактическое хирургическое лечение показано только при явной угрозе кровотечения, т. е. при ВРВ пищевода и желудка II–III степени с наличие «красных знаков» и эзофагита. При I и II степени без нарушений трофики слизистой оболочки оперативное лечение не выполняют, проводят медикаментозную терапию с ежегодным эндоскопическим контролем.
При внепеченочной ПГ показания к профилактическому хирургическому лечению более широкие, так как успешное портокавальное шунтирование приводит этих пациентов к выздоровлению.
Диуретико-резистентный асцит при портальной гипертензии также является показанием к хирургическому лечению, так как качество жизни этих пациентов крайне низкое, а дальнейшее консервативное лечение бесперспективно. Поскольку стойкий асцит, как правило, является признаком декомпенсации цирроза печени, риск выполнения серьезных операций велик. Поэтому преимущество отдают паллиативным хирургическим вмешательствам. Решается вопрос о возможности трансплантации печени.
Отбор пациентов с ПГ для выполнения различных хирургических вмешательств — очень ответственный момент. Выбор операции и прогнозирование результатов хирургического лечения для таких пациентов тесно связаны с точной объективизацией тяжести поражения печени, оценкой резервных возможностей печени и организма в целом. Наиболее практичной и удобной считается прогностическая система тестов Чайлда – Пью. Большинство исследователей считают возможным и целесообразным применение хирургического метода лечения ПГ у пациентов функциональных классов А и В. При декомпенсированном циррозе печени (класс С) риск операции крайне высок, и при возникновении кровотечений из ВРВ преимущество отдают малоинвазивным или консервативным методам лечения.
Предоперационная подготовка
Предоперационная подготовка пациентов с ПГ включает нормализацию функций печени, улучшение процессов метаболизма, уменьшение или устранение выраженности клинических проявлений основных симптомов заболевания. Комплекс лечебных мероприятий состоит из общих и специализированных методов.
Общие направления лечения:
- инфузионно-трансфузионная терапия с переливанием препаратов крови по показаниям (альбумина, плазмы, эритроцитарной массы), глюкозо-солевых растворов, направленная на коррекцию метаболических нарушений и анемии;
- кардиспецифичная терапия при наличии признаков сердечной недостаточности;
- витаминотерапия (препараты группы В);
- местное и общее лечение воспалительных поражений слизистой оболочки пищевода и желудка;
- при активном процессе в печени — короткий курс гормонотерапии преднизолоном
Специализированные методы предоперационной подготовки:
- при отечно-асцитическом синдроме — диуретическая терапия под контролем водного баланса;
- медикаментозная профилактика угрозы кровотечения из варикознорасширенных вен;
- лечение печеночной энцефалопатии (препараты лактулозы, орнитин);
- антиоксидантная терапия;
- нутриентно-метаболическая терапия, направленная на коррекцию белково-энергетической недостаточности и важнейших обменных нарушений. Парентеральное питание современными адаптированными аминокислотными смесями, или энтеральное питание в дополнения к натуральным пищевым продуктам специализированными белково-аминокислотные модули, содержащими минеральные вещества, микроэлементы и витамины.
Методы оперативного лечения
Портокавальное шунтирование (ПКШ) при внутрипеченочной ПГ.
За более чем столетнюю историю предложено множество различных видов портокавальных анастомозов (ПКА), которые разделяются на 3 основных типа: тотальные, селективные и парциальные.
Тотальное шунтирование выполняется с помощью сосудистых анастомозов крупного диаметра между нижней полой и воротной венами или ее ветвями (селезеночной или верхней брыжеечной венами) (рисунок 10). При этом достигается максимальная декомпрессия всей портальной системы и с ликвидацией портальной гипертензии и угрозы кровотечения из ВРВ. Однако существенные недостатки прямых тотальных ПКА препятствуют их широкому клиническому применению. При этих анастомозах прекращается антеградный кровоток по воротной вене, а в некоторых случаях, помимо шунтирования портальной крови, возможен ретроградный кровоток из печени через воротную вену в анастомоз и тем самым шунтирование не только венозной, но и артериальной составляющей общего печеночного кровотока. В раннем послеоперационном периоде высока вероятность развития острой печёночной недостаточности и энцефалопатии, которые приводят к летальному исходу в 25 % случаях. В отдаленном периоде 30 % пациентов умирает в течение первых 2 лет от прогрессирующей печеночной недостаточности, а у половины пациентов развивается тяжелая степень хронической энцефалопатии, приводящая к инвалидности. В связи с указанными обстоятельствами в последние годы наибольшее распространение получило селективное и парциальное ПКШ.
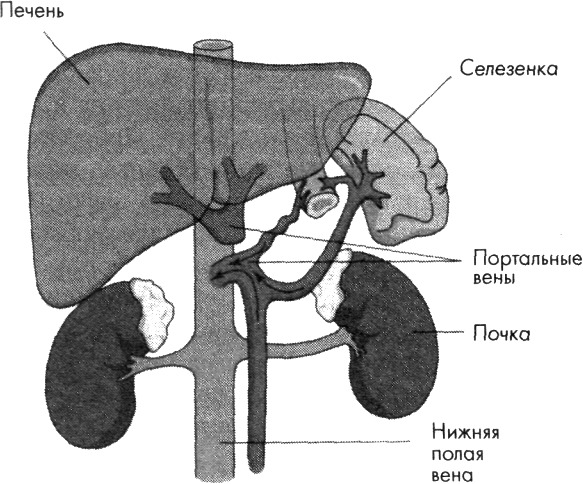
Рисунок 10 — Тотальное портокавальное шунтирование (воротная вена анастомозирована с нижней полой веной по типу «конец в бок»)
Селективное ПКШ подразумевает избирательную декомпрессию селезеночного и гастроэзофагального бассейнов путем наложения дистального спленоренального и гастрокавального анастомозов (рисунок 11). Несмотря на техническую сложность дистальный спленоренальный анастомоз (операция Уоррена) широко распространен в мире благодаря высокой эффективности в отношении профилактики кровотечений из ВРВ, а также в связи с сохранением редуцированного воротного кровотока по брыжеечным венам, что позволяет в раннем послеоперационном периоде снизить вероятность развития острой печеночной недостаточности и энцефалопатии. Одной из основных причин послеоперационной летальности является травматический панкреатит при мобилизации селезеночной вены, приводящий к тромбозу анастомоза и рецидиву кровотечения из варикозных вен.
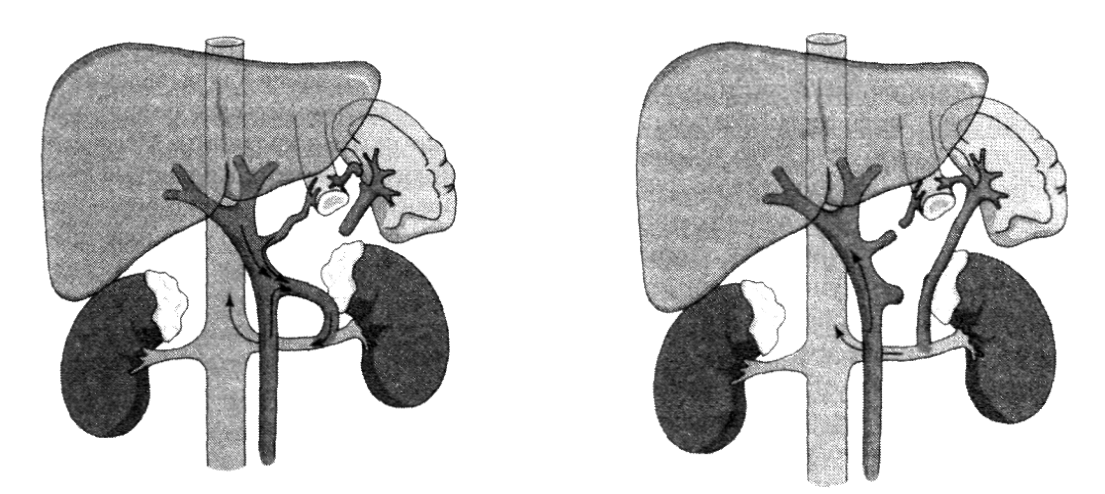
Рисунок 11 — Селективные портокавальные анастомозы: слева — проксимальный (центральный) спленоренальный анастомоз; справа — дистальный сплено-ренальный анастомоз Уоррена.
Гастрокавальный анастомоз является селективным и парциальным. Воротный кровоток сохраняется как в ближайшем, так и в отдаленном периоде. Однако операция не получила широкого распространения в связи с частым отсутствием желудочных вен достаточного диаметра для создания адекватного анастомоза.
Парциальное ПКШ осуществляется путем наложения анастомозов «бок в бок» и «Н»-типа малого диаметра (8–10 мм) с любым сосудом портальной системы, кроме воротной вены (рисунок 12). При этом решается важная дилемма: с одной стороны, обеспечивается достаточная декомпрессия портальной системы с регрессией ВРВ, а с другой — сохраняется редуцированный воротный кровоток для поддержания функционирования печени.
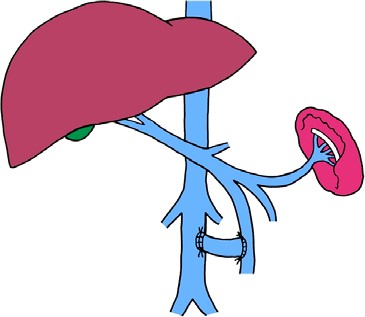
Рисунок 12 — Парциальный мезентерико-кавальный анастомоз «Н»-типа (используется синтетический протез или аутовена) ПКШ при внепеченочной ПГ
Целесообразность ПКШ у пациентов с внепеченочной ПГ при технической возможности выполнения в настоящее время общепризнанна. При этом развитие гепатопортальной энцефалопатии у этой категории пациентов не наблюдается. Такая операция практически всегда приводит к полному выздоровлению, как правило, молодых и трудоспособных людей. Предложено более 30 видов ПКА, преимущество отдают анастомозам «бок в бок» и «Н»-типа с размерами сосудистых соустьев и трансплантатов, превышающих размеры портального сосуда. Таким образом, достигается адекватная декомпрессия центрального и периферического концов анастомозируемого сосуда. Достаточно эффективным и наиболее часто выполняемым видом анастомоза является мезентерикокавальный анастомоз «Н»-типа с использованием аутоили аллотрансплантата.
Прогноз. Послеоперационная летальность при внепеченочной ПГ составляет 0,5–2,0 %, у пациентов с циррозом печени класса А — 3–8 %, класса В — 12–15 %. Пятилетняя выживаемость у пациентов с внепеченочной ПГ составляет 90–95 %, при циррозе печени класса А — 60–70 %, класса В — 30–40 %.
Портокавальное шунтирование при болезни Киари возможно только при отсутствии сужения нижней полой вены и нормальном давлении в ней. Шунтирующая операция способствует уменьшению отека печени, улучшению микроциркуляции и уменьшению асцита. Однако в острой стадии болезни, в связи с тяжестью состояния пациентов шунтирование малоперспективно, а до хронической стадии они доживают редко.
Операции на пищеводе и желудке при ПГ
В связи со сложностью выполнения ПКШ и развитием осложнений актуальными остаются альтернативные способы профилактики и лечения кровотечений из ВРВ пищевода и желудка. К ним относят нешунтирующие вмешательства, из которых наибольшее распространение получили:
- прошивание вен пищевода и желудка путем гастроили эзофагогастротомии из абдоминального, трансторакального и торакоабдоминального доступов;
- деваскуляризация пищевода и желудка, направленная на уменьшение притока портальной крови к желудку и пищеводу;
- операции по разобщению систем воротной и верхней полой вен: транссекция пищевода и желудка (пересечение с последующим сшиванием);
- пищеводно-желудочные резекции.
Прошивание ВРВ пищевода отдельными узловыми или непрерывными кетгутовыми швами было предложено в 1949–1950 гг. в качестве неотложного вмешательства при кровотечении — «операция Берема – Крайля», при этом, на варикозных венах желудка никаких вмешательств не производили. М. Д. Пациора в 1967 г. предложила производить гастротомию из абдоминального доступа в проксимальном отделе желудка с прошиванием всех расширенных вен в кардиальном отделе желудка, а затем, потягивая за лигатуры, максимально высоко прошивать вены пищевода. И в настоящее время операция Пациоры является одним из самых распространенных вмешательств при острых пищеводно-желудочных кровотечениях при безуспешности консервативной терапии (рисунок 13).
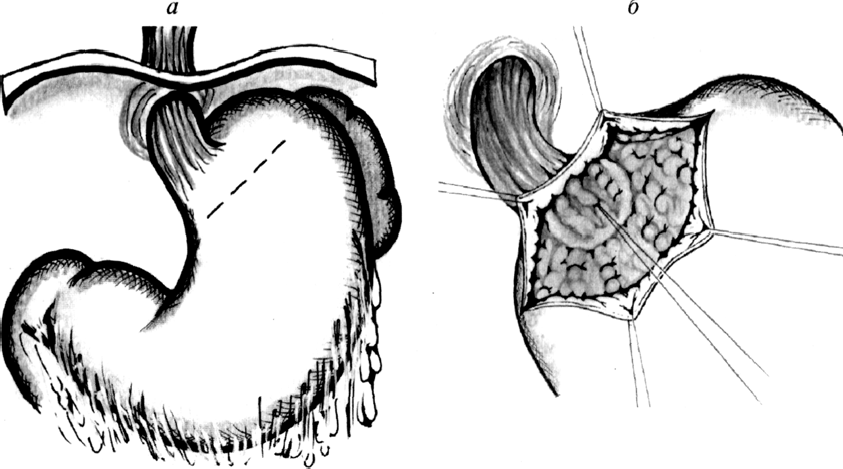
Рисунок 13 — Операция Пациоры (гастротомия, прошивание ВРВ)
Уменьшение притока портальной крови к желудку и пищеводу (деваскуляризация). В 1967 г. египетский хирург М. А. Хассаб для лечения и профилактики гастроэзофагальных кровотечений при ПГ предложил выполнять обширную деваскуляризацию желудка и нижнего отдела пищевода, включая наддиафрагмальные вены, в сочетании со спленэктомией. В настоящее время деваскуляризацию пищевода и желудка выполняют изолированно, т. е. без спленэктомии, или в сочетании с транссекцией пищевода.
Операции по разобщению систем воротной и верхней полой вен. В 1949 г. Таннер предложил производить транссекцию желудка, т.е. пересечение желудка на 5 см ниже кардии с последующим сшиванием. В последующем операция Таннера была модифицирована — без вскрытия просвета желудка прошивают его стенку циркулярно через все слои узловыми шелковыми швами, далее линию основных швов закрывают погружными серозно-мышечными швами. Однако анализ отдалённых результатов показал неэффективность операции в связи с рецидивами кровотечений вследствие реваскуляризации в зоне транссекции.
В настоящее время ограниченно выполняется аппаратная транссекция (с помощью EEA-stapler) с деваскуляризацией верхнего отдела желудка лапароскопическим доступом (рисунок 14). Аппаратная изолированная транссекция пищевода «оставляет без внимания» вены желудка, а, следовательно, риск возникновения кровотечений из них сохраняется.
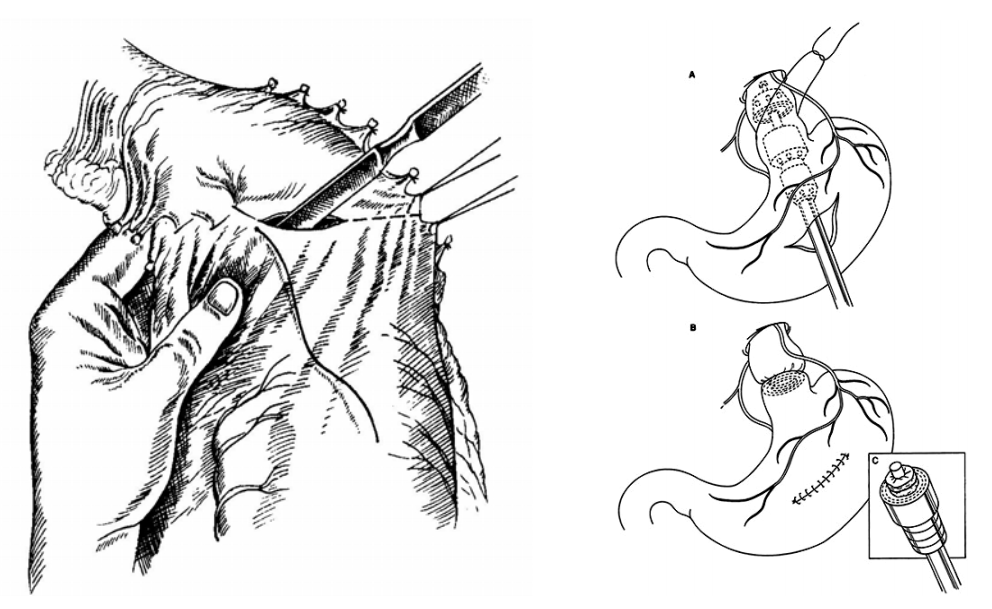
Рисунок 14 — Операция Таннера (слева), аппаратная транссекция пищевода (справа).
В 1973 г. Сугиура и Футагава разработали комбинированную операцию через торакоабдоминальный доступ, включающую транссекцию пищевода, спленэктомию, деваскуляризацию абдоминального отдела пищевода и кардии желудка, селективную проксимальную ваготомию и пилоропластику (рисунок 15). Выполнение такого обширного вмешательства в экстренном порядке при кровотечении и в плановом порядке сопряжено с высоким риском развития осложнений и летального исхода.
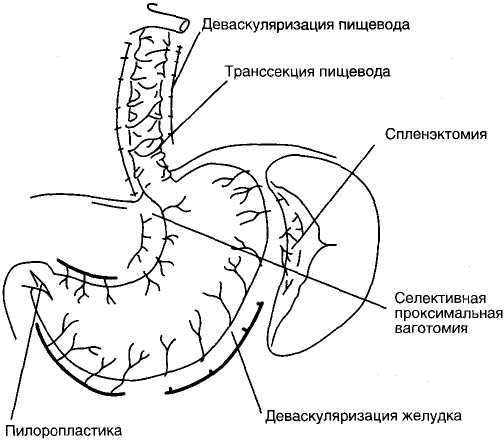
Рисунок 15 — Схема операции М. Сугиура
Пищеводно-желудочные резекции. В качестве «последней, резервной» операции у пациентов, ранее многократно оперированных по поводу рецидивов кровотечений из пищевода и желудка применялась частичная эзофагогастрэктомия в различных модификациях, в том числе с интерпозицией сегмента толстой или тонкой кишки. Однако отдаленные результаты этих операций оказались малоутешительными. У большинства больных в отдаленном периоде развивалась тяжелая агастральная астения, отмечены рецидивы кровотечений из эрозий культи желудка. В настоящее время данные операции производят в исключительных случаях.
Спленэктомия как самостоятельная операция выполняется крайне редко по строгим показаниям: геморрагический синдром, гемолиз, инфантилизм, невозможность выполнить ПКШ без удаления селезенки или прошить ВРВ желудка и пищевода, при перисплените с болевым синдромом, а также по гематологическим показаниям у больных с заболеванием системы крови. Эту операцию считают операцией выбора только у больных с сегментарной портальной гипертензией при окклюзии селезеночной вены. После операции ВРВ желудка полностью исчезают.
Лечение асцита
В соответствии с рекомендациями Международного общества по изучению асцита, пациентам с асцитом 1 степени назначают только диету с ограничением соли до 1,5 г в сутки.
При асците 2 степени в дополнение к диете назначают мочегонные препараты: спиронолактон или амилорид. При периферических отеках дополнительно назначают фуросемид.
Пациентам с асцитом 3 степени выполняют тотальный парацентез (лапароцентез) с назначением раствора альбумина человека из расчета 8– 10 г на каждый удаленный литр асцитической жидкости для профилактики гиповолемии и циркуляторных расстройств. Эта процедура безопасна, эффективна и имеет меньше побочных эффектов, чем диуретическая терапия. При эвакуации жидкости объемом > 5 л предпочтительнее назначение раствора альбумина, а не плазмозамещающих растворов (декстран с различной молекулярной массой). В дальнейшем, ввиду задержки натрия у таких пациентов, им назначают достаточно высокие дозы мочегонных препаратов в сочетании с бессолевой диетой.
Диуретическую терапию считают адекватной при снижении массы тела на 1,0 кг в день у пациентов с асцитом и периферическими отеками и на 0,5 кг в день при наличии лишь одного асцита.
Радикальный метод лечения цирроза печени, осложненного резистентным (рефрактерным) асцитом, — трансплантация печени, что часто сопряжено с длительным наблюдением пациента в листе ожидания на трансплантациию. Поэтому в течение этого периода пациенты подвергаются многократным парацентезам (по необходимости 1 раз в 2–4 нед.) в сочетании с внутривенной трансфузией раствора альбумина, а при возможности и трансъюгулярному портосистемному шунтированию (TIPS) (рисунок 16).
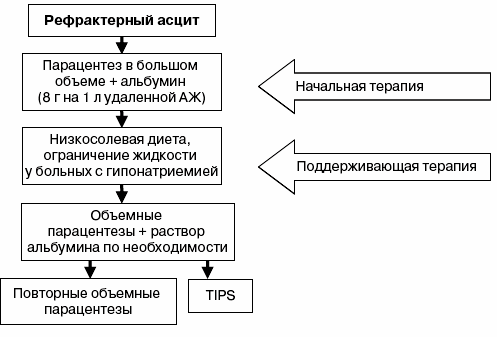
Рисунок 16 — Тактика ведения пациентов с рефрактерным асцитом
Методика проведения парацентеза (лапароцентеза)
При обращении к врачу пациенту с впервые выявленным асцитом ему обязательно проводят исследование асцитической жидкости — диагностический абдоминальный парацентез. Цель: выявление причины возникновения асцита, поэтому асцитическую жидкость направляют на биохимическое и цитологическое исследование. Если пациенту с асцитом ранее уже был установлен и подтвержден цирроз печени, то показаниями к проведению диагностического парацентеза служат:
- факт госпитализации пациента;
- признаки перитонита или инфекции;
- печеночная энцефалопатия;
- ухудшение функции почек;
- желудочно-кишечное кровотечение (перед назначением антибиотиков).
Пациентам с напряженным асцитом для облегчения их состояния и уменьшения одышки выполняют лечебный объемный парацентез.
Парацентез — достаточно безопасная процедура, при правильном проведении которой осложнения составляют < 1 % (повреждение внутренних органов, расширенных вен брюшной стенки, инфекционные осложнения и др.).
Подготовка к проведению парацентеза: пациент должен быть натощак, с опорожненным мочевым пузырем, отсутствием аллергии на местные анестетики. Перед проведением парацентеза необходимо получить информированное согласие пациента на проведение процедуры. Манипуляцию проводят в стерильных условиях. Кожу пациента обрабатывают антисептиком, затем место прокола обкладывают стерильной тканью. Проводят местную инфильтрационную анестезию места прокола, скальпелем производят рассечение кожи, затем осторожно вращающими движениями вводят жесткий металлический троакар или мягкий катетер на троакаре из стерильного набора для выполнения парацентеза. При этом отчетливо ощущается прокол апоневроза и менее заметный прокол брюшины. Прокол производят на 2–3 см ниже пупка по срединной линии тела либо на 3– 4 см медиальнее и выше переднего верхней ости подвздошной кости (рисунок 17). Для предотвращения последующего подтекания жидкости перед введением троакара кожа смещается вниз на 2 см. Рекомендуется продленное фракционное удаление жидкости в течение 1 ч с целью недопущения резкого снижения давления в брюшной полости под постоянным контролем состояния пациента, артериального давления. После прекращения поступления жидкости по трубке последнюю извлекают, на рану кожи накладывают шов, асептическую повязку.
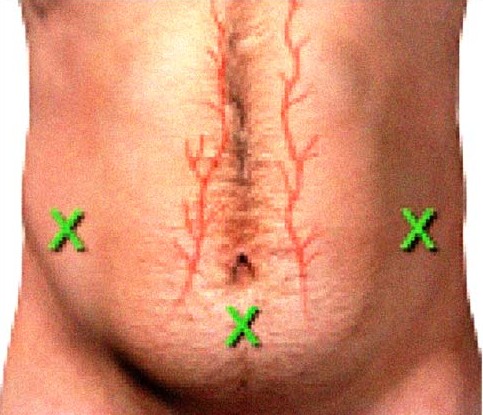
Рисунок 17 — Точки пункции брюшной полости при асците
Хирургическое лечение резистентного асцита
Резистентный асцит у пациентов с циррозом печени и ПГ в настоящее время рассматривается как одно из показаний к трансплантации печени. Все другие операции являются паллиативными, могут лишь на короткий период времени улучшить качество жизни у некоторых пациентов.
Лимфовенозный анастомоз между шейным отделом грудного лимфатического протока и внутренней яремной веной, получивший широкое распространение в 70–80-е гг. XX в., в настоящее время применяется редко. Он эффективен лишь у некоторых пациентов с активной стадией цирроза печени и при синдроме Бадда-Киари.
Утратила свое значение и операция Кальба — создание «окон» в заднем листке париетальной брюшины для всасывания жидкости в забрюшинную клетчатку.
Эндоваскулярные вмешательства, которые направлены на редукцию артериального кровотока печени и селезёнки, также не получили широкого распространения в связи с низкой эффективностью и высокой вероятностью развития инфаркта этих паренхиматозных органов.
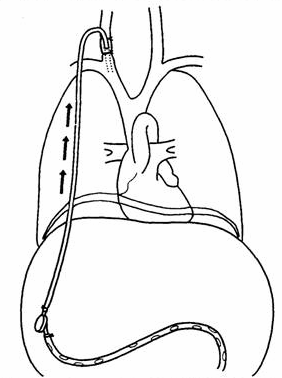
Рисунок 18 — Схема операции перитонеовенозного шунтирования
Наибольшее распространение среди паллиативных хирургических вмешательств получило перитонеовенозное шунтирование с помощью клапана Ле Вина (LeVeen) или Денвера. В качестве шунта применяют подкожно проведенную пластиковую трубку с однонаправленным клапанным механизмом (рисунок 18). Жидкость из брюшной полости оттекает в яремную вену при периодической ручной компрессии на клапанную камеру. Операция положительно влияет на увеличение диуреза и уменьшение асцита, значительно улучшается самочувствие. Однако зачастую шунт функционирует менее 1 года, наступает обтурация клапана, в связи с чем необходима его замена или удаление.
Эндоваскулярные вмешательства при ПГ
Возникающие осложнения после наложения травматичных прямых портокавальных анастомозов привели к разработке эндоваскулярных технологий при ПГ. Одной из первых была предложенная в 1974 г. А. Лундерквистом и Дж. Вангом чрескожная чреспеченочная облитерация внеорганных вен желудка. Происходит разобщение портокавального перетока крови путем эмболизации левой желудочной и коротких вен желудка с помощью металлических спиралей или других эмболизирующих материалов. Данное вмешательство выполнимо только у пациентов с циррозом печени при проходимой воротной вене и эффективно при рецидивах кровотечений из вен желудка. Его можно повторять через 6 мес. в случае реканализации тромбированных вен. Опасным осложнением может явиться распространяющийся тромбоз воротной вены и рецидивирующие кровотечения из ВРВ пищевода и желудка.
В 1969 г. Дж. Рошем был разработан метод трансъюгулярного (чрезъяремного) интрапеченочного портосистемного шунтирования (TIPS — Transjugular intrahepatic portosystemic shunt). Путем пункции яремной вены проводят проводник в печеночные вены и с помощью специальных сосудистых эндопротезов формируют внутрипеченочный шунт между крупными печеночными венами и ветвями воротной вены. В результате этой операции кровь из воротной вены, минуя печень, по шунту попадает сразу в нижнюю полую вену (рисунок 19). Портальное давление снижается на 30 % с сохранением гепатопетального кровотока. Вследствие этого исчезает асцит и уменьшается кровоток по расширенным венам пищевода и желудка. Эта процедура является аналогом традиционного хирургического портокавального шунтирования, но не связана с вскрытием брюшной полости, общим наркозом и сопровождающими традиционные хирургические вмешательства осложнениями. Однако она технически сложна и дорогостояща. TIPS показана при безуспешности консервативного и эндоскопического лечения кровотечений из ВРВ пищевода и желудка, а также в качестве «моста» перед трансплантацией печени. Однако возможны стенозирование и тромбоз шунта с рецидивом кровотечения, что требует повторной установки стента. Отрицательным моментом является развитие энцефалопатии у пациентов.
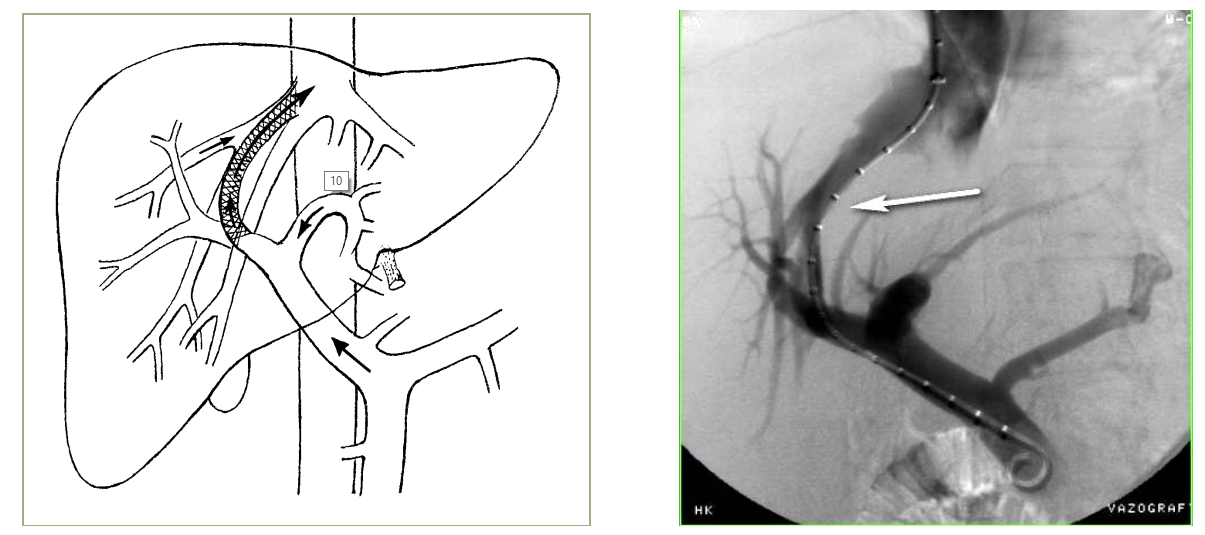
Рисунок 19 — TIPS: слева схема операции; справа — портокаваграмма: установлен внутрипеченочный стент (указан стрелкой)
Эндоскопические вмешательства при портальной гипертензии
К настоящему времени разработаны методы эндоскопического гемостаза для лечения кровотечений из ВРВ пищевода и желудка, а также для профилактики кровотечения при наличии высокого риска геморрагии. Самые распространенные методы эндоскопического лечения ВРВ пищевода и желудка: эндоскопическая склеротерапия, эндоскопическое лигирование и облитерация варикозных вен клеевыми композициями.
Эндоскопическое склерозирование вен пищевода производится путем введения в просвет вены или паравазально склерозанта через эндоскоп.
Для интравазалъной склеротерапии чаще всего используют тетрадецил-сульфат натрия. Последующая временная компрессия вен обеспечивает образование тромба в результате отека эндотелия сосуда (рисунок 20). Однако возможно развитие осложнений: гнойного тромбофлебита, перфорации пищевода, эрозивно-некротических изменений слизистой оболочки пищевода при подслизистом попадании склерозанта.
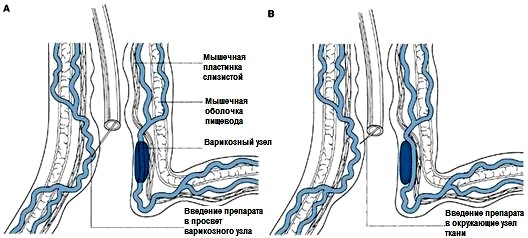
Рисунок 20 — Схема склерозирования ВРВ пищевода: А — интравазальное введение склерозанта; В — паравазальная склеротерапия
При паравазальной склеротерапии варикозных вен пищевода применяется 0,5–1,0 % этоксисклерол. Процедуры можно повторять через 5, 30 дней и 3 мес. Лечение продолжают до достижения положительного результата (4–5 сеансов в год).
Однако зачастую склерозирование ВРВ пищевода оказывается малоэффективным. В последние годы в качестве альтернативы склерозантам применяют цианокрилатные тканевые клеевые композиции. В крови цианокрилат в течение 20 с полимеризуется, вызывая облитерацию сосуда и гемостаз. Через несколько недель клеевая пробка отторгается в просвет желудка. Однако быстрая полимеризация клея может произойти еще в инжекторе, что ограничивает применение данного метода. Кроме того, стоимость клеевых субстанций еще достаточно высока.
Самым перспективным и эффективным методом устранения ВРВ пищевода и желудка является эндоскопическое лигирование с помощью специальных латексных колец или нейлоновых петель (рисунок 21). Через 3–7 суток лигированные узлы некротизируются, покрываются фибрином; в последующем отторгаются с лигатурами с образованием часто обширных поверхностных язв, которые заживают в течение 2–3 нед., оставляя звездчатые рубцы без стенозирования просвета пищевода. Через 2 мес. подслизистый слой замещается, а мышечный остается интактным.
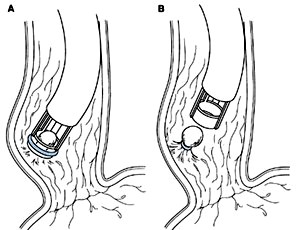
Рисунок 21 — Схема эндоскопического лигирования ВРВ пищевода
После эндоскопического лигирования также могут наблюдать рецидивы кровотечений в результате соскальзывания лигатуры либо из язвенных дефектов после отторжения некротизированных венозных узлов.
Лечение острых варикозных кровотечений
Медикаментозное лечение ПГ
В соответствии с механизмом снижения портального давления все лекарственные средства можно разделить на следующие основные группы.
- Вазодилататоры — влияют на динамический компонент портальной резистентности (нитраты — изосорбида мононитрат). В качестве монотерапии нитраты используют редко, обычно их применяют в сочетании с вазопрессином.
- Вазоконстрикторы — снижают портальное давление, вызывают вазоконстрикцию сосудов внутренних органов и, соответственно, уменьшают объем портальной крови. К прямым вазоконстрикторам относят вазопрессин и его синтетический аналог терлипрессин. Эти препараты непосредственно воздействуют на гладкомышечные клетки сосудов. Механизм действия непрямых вазоконстрикторов связан с ингибированием активности эндогенных вазодилататоров (в частности глюкагона). К этой группе относят соматостатин и его синтетический аналог октреотид.
- Неселективные β-адреноблокаторы: пропранолол, анаприлин, нодолол и др. Данные препараты приводят к снижению портального давления благодаря уменьшению сердечного выброса и урежению пульса. Брадикардия на 25 % снижает давление в воротной вене и на 20–30 % уменьшает риск кровотечения. Дозу препарата подбирают индивидуально. Возможно комбинированное применение β-адреноблокаторов и нитратов.
Варианты тактики:
- При немассивном кровотечении из варикозных вен пищевода и стабильных гемодинамических показателях целесообразно проведение эндоскопической склерозирующей терапии или лигирования вен. Паравазальное или интравазальное введение склерозантов (этоксисклерола) способствует остановке кровотечения более чем у 70 % больных.
- При массивном кровотечении прибегают к баллонной тампонаде варикозных узлов пищевода с помощью зонда Сенгстейкена-Блейкмора или зонда Линтона – Нахласа (при локализации варикозных вен в фундальном отделе желудка). Зонд устанавливают на срок не более 48 ч. У некоторых пациентов после удаления зонда возможно возобновление кровотечения.
- Невозможность остановки кровотечения из варикозных вен пище-
вода, его быстрые рецидивы после первоначального гемостаза, а также необходимость применения больших доз консервированной крови (свыше 6 доз в течение 24 ч) служат показаниями к хирургическому лечению (операция Пациоры, транссекция пищевода, шунтирующие операции).
Рекомендации по лечению острых варикозных кровотечений:
- Раннее (еще на догоспитальном этапе) использование комбинации вазоактивных препаратов терлипрессина, соматостатина, октреотида, вазопрессина в комбинации с нитроглицерином. Лекарственное лечение может продолжаться до 2–5 дней.
- Эндоскопическое исследование (и лечение) должно быть выполнено в экстренном порядке (не позднее 12 ч от начала кровотечения).
- Эндоскопическое лигирование ВРВ пищевода либо склеротерапия — тактика выбора при острых кровотечениях из вен пищевода. При кровотечении из ВРВ желудка — использование эндоскопической обтурации тканевым адгезивом.
- Всем пациентам необходимо профилактическое назначение антибиотиков широкого спектра действия.
При неэффективности эндоскопических и лекарственных методов лечения — наложение трансъюгулярного портосистемного шунта в срочном порядке (рисунок 22).
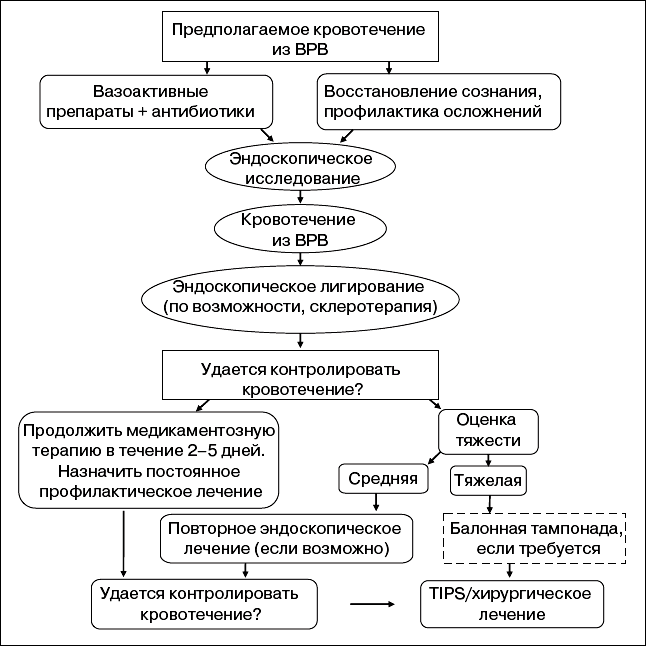
Рисунок 22 — Алгоритм лечения острого кровотечения из ВРВ
Некоторые особенности лечения острых кровотечений из варикозно расширенных вен пищевода и желудка
Основными факторами, «решающими судьбу» пациента с кровотечением, являются: степень кровопотери и исходное функциональное состояние печени по Чайлду – Пью.
Диагностическая тактика
При поступлении пациента в приёмное отделение с клиникой пищеводно-желудочного кровотечения, прежде всего, необходимо оценить тяжесть состояния пациента и информировать эндоскописта о возможном источнике кровотечения на основании анамнеза. Чаще всего у пациентов уже выявляются признаки диффузного поражения печени (желтуха, асцит, гепатоспленомегалия и т. д.), что позволяет ориентировать хирурга на кровотечение портального генеза.
Основной дифференциально-диагностический метод исследования в установлении источника кровотечения — экстренная фиброэзофагогастродуоденоскопия (ФЭГДС). При нестабильной гемодинамике и продолжающемся кровотечении ее выполняют в операционной, после катетеризации центральной вены и начала восполнения объема циркулирующей крови кристаллоидами и кровезаменителями при активном участии анестезиолога для оценки возможности проведения эндоскопического исследования в условиях наркоза.
Задачи ФЭГДС:
- оценка источника и характера кровотечения;
- при продолжающемся кровотечении — эндоскопический гемостаз;
- при спонтанном гемостазе — оценка риска рецидива кровотечения (стабильный, нестабильный гемостаз);
- диагностика сопутствующих заболеваний желудка и двенадцатиперстной кишки, а также тяжелой гастропатии.
Информацию, полученную во время эндоскопического исследования, считают отправной точкой принятия решения о выборе метода лечения. Несмотря на трудности эндоскопического исследования при наличии значительного количества крови и сгустков в желудке, необходимо попытаться осмотреть весь желудок и двенадцатиперстную кишку.
Установка зонда обтуратора
После установления диагноза кровотечения из варикозных вен пищевода или кардии желудка при невозможности эндоскопического гемостаза незамедлительно вводят зонд-обтуратор Сенгстейкена – Блекмора (или его модификации) и раздувают манжетки, чем достигается надежный гемостаз (рисунок 23). Необходимо помнить, что введение зонда и пребывание его в носоглотке в течение многих часов — тяжело переносимая процедура, поэтому необходима премедикация и седация пациента.

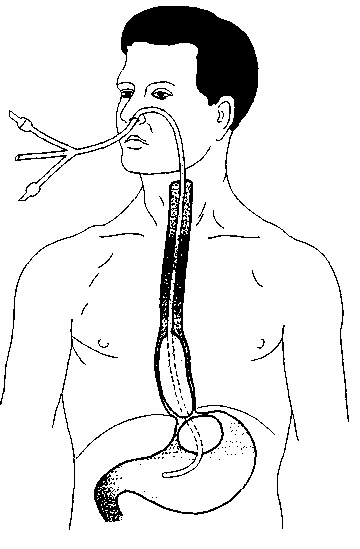
Рисунок 23 — Зонд Блекмора: слева — внешний вид зонда; справа — установленный зонд
Зонд-обтуратор имеет 3 канала (2 — для раздельного раздувания дистального желудочного и проксимального пищеводного баллонов; 3-й канал — для аспирации содержимого желудка). Существует модификация зонда с 4-м каналом для аспирации из проксимального отдела пищевода. Зонд вводят через носовой ход (при невозможности — через рот), заводя баллон в желудок, предварительно замерив расстояние от мочки уха до пупка, что служит ориентиром анатомического расстояния от резцов до желудка. При помощи градуированного шприца, присоединенного к катетеру желудочного баллона, вводят 120–150 см3 воздуха (баллон раздувается в просвете желудка). Затем зонд подтягивают до ощущения упругого сопротивления, чем и достигается сдавление вен в зоне кардии. После этого зонд фиксируют пластырем к коже. Если источником кровотечения являются вены пищевода, то далее раздувают пищеводный баллон небольшими порциями воздуха, первоначально по 30–40 см3, в последующем, — по 10–15 см3 с интервалом в 3–5 мин. Соблюдение этих условий необходимо для адаптации органов средостения к их смещению раздутым баллоном. Общее количество нагнетаемого воздуха в пищеводном баллоне доводят до 60–80 см3 в зависимости от выраженности дилатации пищевода и переносимости пациентом давления баллона на средостение. Оптимальное давление в пищеводном баллоне — 30–40 мм рт. ст. После того как зонд установлен, желудочное содержимое аспирируют, желудок промывают холодной водой. Контроль эффективности постановки зонда осуществляют при динамическом наблюдении за желудочным содержимым, поступающим по зонду.
Во избежание образования пролежней на слизистой оболочке пищевода через каждые 4–6 ч пищеводный баллон спускают на 15–20 мин. Максимальное время нахождения зонда — 48 часов. Перед извлечением зонда сначала спускают пищеводный баллон, затем — желудочный, а спустя несколько часов при отсутствии поступления крови из желудка зонд осторожно извлекают. Сохраняется высокая вероятность рецидива кровотечения, поэтому обязательным является проведение комплексной терапии, направленной на снижение портального давления, коррекцию гемостаза, рациональное восполнение объема циркулирующей крови под контролем центрального венозного давления, не допуская гиперволемии.
Кровотечение из варикозных вен пищевода и желудка у пациентов с циррозом печени усугубляет печеночную энцефалопатию за счет накопления конечных продуктов азотистого обмена. Поэтому необходима дезинтоксикационная терапия.
При безуспешности консервативной остановки кровотечения операцией выбора является трансабдоминальная гастротомия в проксимальном отделе желудка с прошиванием варикозных вен эзофагокардиальной зоны (операция Пациоры).
Эндоскопические и эндоваскулярные вмешательства
При установленном источнике кровотечения из варикозных вен пищевода и желудка гемостаз может быть достигнут эндоскопическими вмешательствами — эндоскопическим лигированием и флебосклерооблитерацией, считающихся методом выбора. Эндоскопический гемостаз особенно целесообразен у пациентов пожилого и старческого возраста, имеющих сопутствующую тяжелую патологию, у пациентов с декомпенсацией печеночной деятельности, желтухой и асцитом, у которых эндоскопические вмешательства являются последней надеждой на гемостаз.
Лечебные эндоскопические вмешательства целесообразны в отсроченном порядке через 10–12 ч после постановки зонда-обтуратора. Временный гемостаз зондом дает возможность отмыть желудок от крови и провести интенсивную инфузионную терапию для стабилизации гемодинамики.
Экстренная эндоскопическая флебосклерооблитерация отличается от плановой процедуры. При обнаружении кровоточащей вены введение склерозанта осуществляют по обе стороны кровоточащего сосуда — паравазально. При этом для получения гемостаза вводят значительное количество склерозанта (10–15 мл 0,5 % раствора этоксисклерола). Однако высока вероятность формирования зоны некроза слизистой, что требует выполнения контрольной эндоскопии через 3–4 дня. Хорошие результаты получены при эндоскопическом инфильтрационном обкалывании источника кровотечения раствором глюкозы и аскорбиновой кислоты для создания инфильтрационной подушки.
При ранних (до 24 ч) рецидивах кровотечения после эндоскопического гемостаза следует решать вопрос в пользу экстренной операции.
При локализации источника кровотечения в пределах пищевода можно использовать методику интравазальной эндоскопической окклюзии варикозных вен: инъекторной иглой в просвет венозного узла вводят 10 мл 1–2 % раствора тетрадецилсульфата натрия с последующим сдавлением вены концом эндоскопа с целью образования тромба в этой сосудистой зоне. Экстренная эндоскопическая склеротерапия в большинстве случаев позволяет достичь гемостаза.
Эндоскопическое лигирование являетсмя наиболее эффективным способом эрадикации варикозных вен пищевода. Затрудненный осмотр пищевода из-за наличия крови не позволяет адекватно контролировать аспирацию вен в эндоскоп, а после сброса лигатуры нет возможности оценить правильность наложения латексного кольца на вену. Поэтому проведение эндоскопического лигирования лучше осуществлять после достижения гемостаза и стабилизации гемодинамики. Первую лигатуру необходимо наложить на венозный узел, являющийся источником кровотечения, далее лигирование проводят от эзофагокардиального перехода и выше по спирали. Противопоказанием к использованию эндоскопического лигирования у крайне тяжелых больных с декомпенсированным циррозом печени служат грубые нарушения ее белково-синтетической функции, так как после отторжения венозных узлов образуются поверхностные изъязвления, для заживления которых требуются значительные пластические и энергетические затраты организма.
Трансплантация печени
Трансплантация печени является единственным радикальным методом лечения пациентов с терминальными стадиями заболеваний печени. Ее проведение является показателем уровня оказания специализированной медицинской помощи в стране. Потребность в трансплантации печени в Беларуси — не менее 100 операций в год.
Показания к трансплантации печени:
- Острая (фульминантная) печеночная недостаточность.
- Циррозы печени, синдром Бадда – Киари.
- Врожденные метаболические заболевания печени (болезнь Вильсона и т. п.).
- Врожденные атрезии желчных протоков.
- Доброкачественные и злокачественные опухоли.
- Прочие заболевания (кистозный фиброз, неонатальный гепатит, врожденный фиброз печени, семейный холестаз, травма печени, поликистоз печени и др.).
Абсолютными противопоказаниями к трансплантации печени являются общие факторы (тяжелые поражения сердечно-сосудистой ситемы, тяжелые заболевания легких, легочная гипертензия, другие декомпенсированные сопутствующие заболевания) и специфические состояния (активный алкоголизм, внепеченочное злокачественное заболевание, ВИЧ инфекция, внепеченочный сепсис, активная репликация вируса гепатита В при отсутствии репликации вируса гепатита В в трансплантанте, непонимание больным характера операции и необходимости пожизненного приема иммуносупрессоров и наблюдения).
Относительные противопоказания к трансплантации печени: общие (возраст > 70 лет, сопутствующие заболевания, поддающиеся медикаментозной или оперативной коррекции) и специфические (отсутствие психологической поддержки больного со стороны его близких родственников, тромбоз воротной вены, билиарная инфекция).