Хроническая болезнь почек
Содержание страницы
1. Анатомия и физиология почек
Структурно-функциональной единицей почки, отвечающей за образование мочи, является нефрон. Каждая почка содержит примерно 1 млн нефронов. Нефрон состоит из почечного клубочка, или тельца, и почечного канальца. Основная масса клубочков расположена в корковом веществе, они называются корковыми. Клубочки, расположенные на границе между корковой и мозговой зонами, называют юкстамедуллярными. Клубочек представляет собой капиллярную сеть, возникшую из приводящей, или афферентной, артериолы. В артериолах имеются гладкие мышцы, регулирующие тонус и ширину просвета сосуда. Это имеет важное значение в регуляции клубочкового кровотока и механизма фильтрации крови в клубочке. Клубочковый фильтр состоит из эпителия клубочка, эндотелия его капилляров и расположенной между ними базальной мембраны. В базальной мембране имеются поры, через которые происходит фильтрация различных веществ.
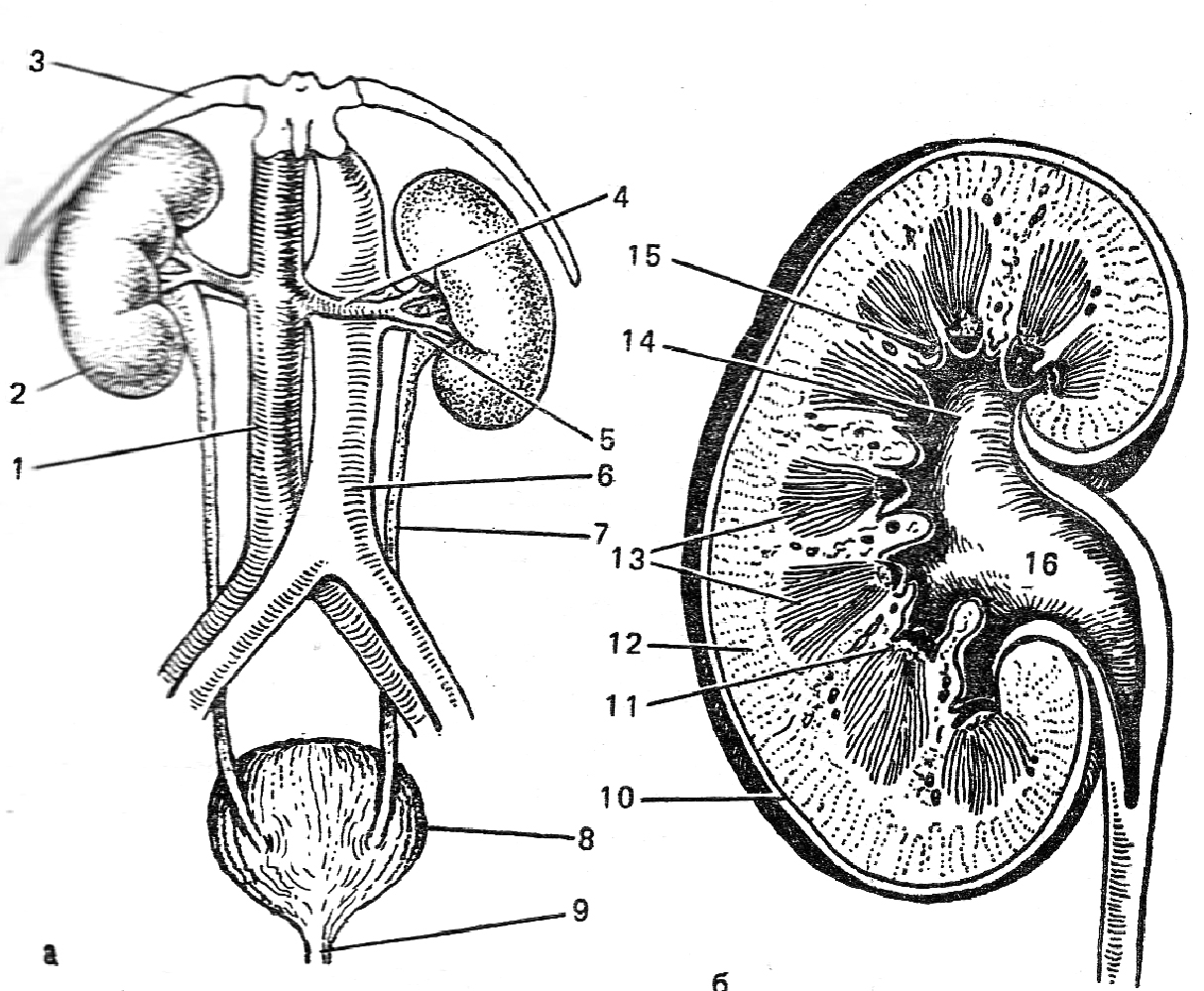
Рисунок 1. Структурные элементы почки.
1 – Схема анатомических соотношений между почками, мочеточниками и мочевым пузырем в брюшной полости (а). поперечный разрез через почку (б). 1 – аорта; 2 – почки; 3 – XI ребро; 4 – почечная артерия; 5 – почечная вена; 6 – нижняя полая вена; 7 – мочеточник; 8 – мочевой пузырь; 9 – мочеиспускательный канал; 10 – капсула; 11 – прирамида; 12 – кора; 13 – мозговое вещество; 14 – чашка; 15 – сосочек; 16 – лоханка.
Капсула клубочка состоит из базальной мембраны и покрывающего ее эпителия. В капсулу собирается профильтровавшаяся из клубочковых капилляров вода, электролиты и другие вещества, которые затем попадают в канальцы. Наружная поверхность капсулы тесно связана с ретикулярной или соединительной тканью почки. Поэтому различные патологические состояния, например, воспалительные изменения в соединительной ткани при пиелонефрите или, наоборот, воспалительные изменения в клубочках при гломерулонефрите, часто приводят к патологическим изменениям как клубочков, так и соединительной ткани, что нередко ведет к склерозированию почечной ткани и может закончиться развитием уремии.
Почечный каналец состоит из начального проксимального, или главного, отдела, берущего начало от капсулы клубочка, тонкого сегмента петли нефрона, дистального отдела и собирательной трубочки. Проксимальный отдел включает извитой и прямой канальцы. Клетки этого участка играют очень важную роль в реабсорбции целого ряда веществ, профильтровавшихся в клубочке (глюкоза, аминокислоты, белки и др.). Через эти клетки происходит выделение из организма различных ядов и токсинов, поэтому при инфекциях и интоксикациях клетки могут подвергаться дистрофическим и даже некротическим изменениям.
Прямая часть проксимального канальца переходит в тонкий сегмент петли нефрона. петля нефрона имеет U-образную форму, образуя нисходящее и восходящее колена, лежащие в мозговом слое почки и идущие параллельно кровеносным капиллярам и собирательной трубочке. Благодаря такому расположению почечных структур происходят процессы осмотического концентрирования мочи.
Дистальный отдел канальца включает прямую и извитую части. Здесь, как и в выше расположенных отделах нефрона, происходит дальнейшая обработка гломерулярного фильтрата с обратной резорбцией некоторых веществ в кровь и, наоборот, с секрецией других, особенно инородных веществ, в мочу. Дистальный извитой каналец контактирует с выносящей артериолой клубочка своего нефрона, а между приносящей и выносящей артериолами расположен юкстагломерулярный аппарат , клетки которого секретируют фермент ренин. Снижение артериального давления в сосудах клубочка и ряд других факторов стимулируют образование ренина в клетках юкстагломерулярного аппарата. Под влиянием ренина увеличивается содержание ангиотензина, последний стимулирует образование в надпочечниках альдостерона. Альдостерон повышает реабсорбцию натрия в дистальном отделе нефрона.
Конечная часть нефрона – собирательные трубочки. Стенка трубочек под действием антидиуретического гормона, вырабатываемого нейрогипофизом, становится проницаемой для воды. Это способствует концентрированию мочи и сохранению постоянства состава и объема внеклеточной жидкости организма.
Функция клубочков. Функция клубочков состоит в образовании с помощью ультрафильтрации так называемой первичной мочи. Хотя в образовании мочи участвуют все отделы нефрона, процесс начинается в клубочках. Переход воды, электролитов и других веществ из капилляров клубочка в его капсулу осуществляется с помощью ультрафильтрации. свободно фильтруется через мембрану капилляра только низкомолекулярные вещества. По своему химическому составу первичная моча не содержит белков, а концентрация в ней осмотически активных веществ, глюкозы, аминокислот, мочевины, креатинина такая же, как в плазме крови. По мере увеличения молекулярной массы веществ прохождение их через мембранные поры капилляров клубочка затрудняется. происходит как бы молекулярное «просеивание».Состав фильтрата, следовательно, определяется размерами пор мембраны клубочка. Помимо размеров пор, СКФ зависит от гидротатического давления жидкости в капилляре, и чем оно выше, тем фильтрация больше. В норме гидростатическое давление составляет 10–20 мм рт.ст. Противодействует фильтрации онкотическое давление крови капилляра, которое создается белками плазмы, не проникающими через фильтр, и давлением жидкости в капсуле клубочка. Почечный кровоток и клубочковая фильтрация обладают определенной независимостью от колебаний общего артериального давления, т.е. они обладают собственной регуляцией (ауторегуляцией). Ауторегуляция сохраняет на постоянной уровне почечный кровоток при колебаниях АД в пределах 80 – 180 мм рт.ст. При его снижении до 50 мм рт.ст и ниже возникают тяжелые нарушения почечного кровотока, которые могут сопровождаться анурией с явлениями острой почечной недостаточности.
Ультрафильтрат, или первичная моча (120 мл/мин), составляет 20% от всего количества плазмы, прошедшей через почки за то же время (600 мл/мин). Очищение крови от различных веществ обозначается термином «клиренс». Скорость очищения плазмы от данного вещества пропорциональна концентрации его в крови. Клиренс вещества (С) определяется по формуле: С =U/P ×V (мл/мин), где U – концентрация вещества в моче и Р – концентрация вещества в плазме, V – объем мочи, образованной за 1 мин. Клиренс какого-либо вещества количественного равен объему плазмы крови, полностью очищенный от этого вещества за 1 мин. Если вещество свободно фильтруется в клубочке и не реабсорбируется и не секретируется в канальце, то его клиренс соответствует клубочковой фильтрации (к таким веществам относятся инулин и креатинин).Любое вещество, которое полностью фильтруется в клубочках, но имеет меньшую величину клиренса, чем инулин или креатинин, реабсорбируется в канальцах. Такими веществами являются, в первую очередь, ионы натрия, хлора, калия, воды,глюкоза, мочевина, аминокислоты и мочевая кислота. Если клиренс вещества выше, чем у инулина или креатинина, то это вещество секретируется в мочу клетками канальцев. К таким веществам относятся ионы водорода.
Функция канальцев. Функция канальцев заключается в реабсорбции электролитов, воды, органических веществ из канальцевой жидкости и секреции в просвет канальца ряда веществ, которые образуются в канальцевых клетках или находятся в околоканальцевых капиллярах. В результате этих процессов из первичной мочи, т.е. клубочкового фильтрата, образуется конечная моча, поступающая по мочеточникам в мочевой пузырь.
Клубочковый фильтрат превращается в конечную мочу по мере продвижения его по канальцу. С помощью реабсорбции из просвета канальца транспортируется 99% первоначального фильтрата. При этом в проксимальном канальце полностью реабсорбируются глюкоза и белки; ионы натрия реабсорбируются примерно на 70%. Восходящее колено петли нефрона мало проницаемо для воды и хорошо проницаемо для ионов натрия и хлора. Это приводит к созданию разной осмотической концентрации в нисходящем и восходящем коленах петли, что создает условия для механизма концентрирования мочи. В дистальном канальце реабсорбируются ионы натрия и вода, натрий заменяется ионами калия, водорода, аммония.
Реабсорбция глюкозы. Глюкоза свободно проходит через клубочковый фильтр и в нормальных условиях в моче не обнаруживается. Это значит, что глюкоза полностью реабсорбируется в канальцах. Реабсорбция глюкозы происходит в проксимальном канальце, в основном в его начальном отделе. В дистальном отделе нефрона глюкоза не реабсорбируется. Таким образом, по реабсорбции глюкозы можно судить о функции проксимального канальца. Транспорт глюкозы из просвета канальца во внеклеточную, или перитубулярную жидкость является активным процессом, идущим с затратой энергии. Значительное повышение содержания глюкозы в плазме (гипергликемия), например при сахарном диабете, сопровождается появлением глюкозы в моче (гликозурия). Это значит, что по мере повышения концентрации глюкозы в плазме наступает момент, когда все возможности реабсорбции глюкозы в проксимальных канальцах исчерпаны (примерно при концентрации глюкозы в сыворотке крови 10 ммоль/л) и возникает гликозурия. Этот момент соответствует максимальной скрорости реабсорбции глюкозы. При поражении почек, сопровождающемся уменьшением количества функционирующих нефронов, например, у больных с сахарным диабетом и развитием склеротических изменений в почках, гликозурия возникает при более низком содержании глюкозы в плазме крови.
Реабсорбция белков. Протеинурия чаще связана с повышенной фильтрацией плазменных белков через клубочковые капилляры – это так называемая клубочковая (гломерулярная) протеинурия. Она наблюдается при большинстве заболеваний почек: при гломерулонефритах (первичных и при системных заболеваниях), амилоидозе почек, диабетическом гломерулосклерозе, а также при гипертонической болезни. Канальцевая протеинурия связана с неспособностью проксимальных канальцев реабсорбировать плазменные низкомолекулярные белки, профильтрованные в нормальных клубочках. Протеинурия переполнения развивается при повышенном образовании плазменных низкомолекулярных белков (легких цепей иммуноглобулинов, гемоглобина, миоглобина), которые фильтруются нормальными клубочками в количестве, превышающем способность к реабсорбции. Таков механизм протеинурии при миеломной болезни (протеинурия Бенс-Джонса), миоглобинурии. Нормальная концентрация потери белка за сутки 0,2 – 0,4 г. Суточная протеинурия имеет не только диагностическое значение, но и позволяет в ряде случаев оценивать тяжесть поражения почек, судить о динамике процесса. Еще большее значение в этом плане имеет исследование селективности протеинурии. Селективная протеинурия характеризуется наличием в моче белков с относительной молекулярной массой менее 85000 (альбумин, трансферрин). Неселективная протеинурия обусловлена прохождением в мочу всех плазменных белков без различия молекулярных фракций. Считается, что у больных с селективной протеинурией прогноз заболевания благоприятнее, результаты лечения эффективнее.
2. Определение и критерии
Хроническая болезнь почек может быть определена как повреждение почек или снижение функции почек в течение трех месяцев или более, независимо от диагноза. Современные критерии ХБП приведены в таблице 1.
Таблица 1. Критерии ХБП (К/DOQI, 2008).
| 1. Повреждение почек продолжительностью 3 мес., которое характеризуется структурными или функциональными нарушениями почек со снижением или без снижения СКФ, проявляющееся одним из признаков:
— изменениями мочи или визуальных тестов — морфологическими нарушениями или 2. СКФ < 60 мл/мин/1,73 м² в течение ≥3 месяцев при наличии или отсутствии признаков повреждения почек |
3. Эпидемиология
Во всем мире наблюдается увеличение количества больных с хронической почечной патологией в связи с нарастанием заболеваемости сахарным диабетом, постарением населения и, соответственно, ростом числа пациентов с повреждениями почек.
По данным крупных популяционных регистров (NHANTS III, Okinawa Stady), распространенность хронической болезни почек (ХБП) составляет не менее 10%, достигая более 20% у отдельных категорий лиц (пожилые, страдающие сахарным диабетом 2 типа).
Расчетные данные показывают, что в Иркутске должно быть около 82000 пациентов с ХБП, в том числе с 1 стадией – 34000, 2 и 3 стадией – по 23000, 4 и 5 стадией – по 1200 человек (NHANES III).
4. Этиология
Выделяют факторы риска развития ХБП, которые делят на предрасполагающие, инициирующие повреждение почек и влияющие на скорость прогрессирования (таблица 2).
Заболевания, приводящие к ХБП:
- заболевания клубочков (хронический гломерулонефрит); канальцев и интерстиция (хронический тубулоинтерстициальный нефрит, в том числе пиелонефрит)
- диффузные болезни соединительной ткани (системная красная волчанка, системная склеродермия, узелковый полиартериит, гранулематоз Вегенера, геморрагический васкулит)
- болезни обмена веществ (сахарный диабет, амилоидоз, подагра, гипероксалатурия);
- врожденные заболевания почек (поликистоз, гипоплазия почек, синдром Фанкони)
- первичные поражения сосудов: АГ, стеноз почечных артерий
- обструктивные нефропатии: мочекаменная болезнь, опухоли мочеполовой системы
- лекарственные поражения почек (ненаркотические анальгетики, нестероидные противовоспалительные и другие препараты)
- токсические нефропатии (свинцовая, кадмиевая, кремниевая, алкогольная)
Таблица 2. Основные факторы риска ХБП (K/DOQI, 2002, 2006).
| Факторы | Примеры |
| Предрасполагающие | пожилой возраст
семейный анамнез |
| Инициирующие | диабет
АГ иммунные заболевания системные инфекции инфекции мочевых путей мочевые камни обструкция нижних мочевыводящих путей токсичность лекарств |
| Прогрессирования | АГ
гипергликемия дислипидемия курение выраженная протеинурия |
5. Патогенез
Большинство хронических заболеваний почек имеют единый механизм прогрессирования. В результате гибели части нефронов, обусловленной основным заболеванием (гломерулонефрит, сахарный диабет, сосудистый гломерулосклероз и пр.), в оставшихся непораженными нефронах развиваются компенсаторные структурные и функциональные изменения. Эти изменения представлены внутриклубочковой гипертензией, гиперфильтрацией, гипертрофией нефронов в результате активации внутрипочечной (тканевой) ренин-ангиотензиновой системы.
На ранних этапах формирования почечной недостаточности отмечается снижение функционального резерва почки, в частности, уменьшение способности к росту СКФ в ответ на белковую нагрузку. На этом этапе течение почечной дисфункции бессимптомно. Дальнейшая потеря функционирующих нефронов (до 30% от нормы) приводит к более выраженным нарушениям функции почек — повышению концентрации азотистых метаболитов (мочевины, креатинина), нарушению баланса электролитов, анемии и т.д.
Клинические проявления
- Изменения в моче
- Анемия
- Геморрагический синдром
- Артериальная гипертензия
- Иммунологические нарушения
- Метаболические и эндокринные расстройства
- ОПН, вызванная: инфекцией, дегидратацией, токсическим действием лекарства
- Уремия
1. Жалобы, анамнез, внешний вид
К проявлениям ХБП (которые можно объяснить интоксикацией, свойственной азотемии), можно отнести: снижение аппетита, сухой и неприятный вкус во рту, тошнота, тяжесть в эпигастрии. Также типичны полиурия и никтурия, утомляемость, зябкость, инверсия сна (бессонница ночью и сонливость днем), кожный зуд, тонические судороги икроножных мышц. При тяжелой артериальной гипертензии нередко бывают головные боли и снижение зрения вплоть до полной слепоты. Достаточно часто больные предъявляют жалобы, связанные с поражением сердца: боль в левой половине грудной клетки, одышка, сердцебиение. Боль в левой половине грудной клетки может быть связана с коронарной недостаточностью. Однако при наличии уремии сильные боли могут быть обусловлены и поражением перикарда. Одышка появляется достаточно рано.
При осмотре отмечается достаточно характерный внешний вид: лицо несколько отечно, одутловато, кожа желтушная с серым оттенком (в результате гипорегенераторной анемии вследствие уменьшения продукции эритропоэтина и «прокрашивания» урохромами), сухая (больные не потеют), тургор снижен, с геморрагиями и следами расчесов и как следствие их гнойнички.
Зуд кожи – достаточно тягостный симптом, который объясним гиперпаратиреоидизмом. Мышцы дряблые. Характерны артралгии и моноартриты, вследствие вторичной подагры, интенсивные боли и резкая слабость в нижних конечностях (уремическая полинейропатия), поражение костей (остеодистрофия), частые носовые кровотечения, одутловатость лица, запах аммиака изо рта (признак тяжелой уремии). Больные вялы, апатичны, медлительны в движениях, ответах на вопросы. У молодых больных выявляется лимфаденопатия.
2. Основные симптомы
Поражение нервной системы
Ранние признаки уремической энцефалопатии: снижение памяти, способности к простым математическим действиям, инверсия сна.
При тяжелой уремии наступает уремическая кома. Другие варианты поражения ЦНС: отек мозга (при тяжелом гипертоническом кризе, гипергидратации, гипонатриемии), а также диализные энцефалопатии.
Уремическая периферическая полинейропатия проявляется синдромом «беспокойных ног», парестезиями, жжением в нижних конечностях. На поздней стадии развиваются парезы, часто необратимые.
Водно-электролитные нарушения
Полиурия с никтурией – ранний симптом, развивающийся вследствие снижения концентрационной функции почек.
Среди причин нарушения концентрационной функции: снижение тубулярной реабсорбции натрия и воды, резистентность канальцевого эпителия к антидиуретическому гормону, тяжелое поражение почечных сосочков.
В терминальной стадии резко нарушается водо-выделительная функция: развивается олигурия, гипергидратация и отечный синдром. Нарушается реакция на водную нагрузку с риском водной интоксикации.
Задержка натрия возникает из-за снижения способности почек к натрийурезу и вторичного гиперальдостеронизма. При поступлении с пищей натрия выше величины его максимальной экскреции, развивается гипернатриемия с гиперволемией. Симптомы задержки натрия следующие: внеклеточная гипергидратация, внутриклеточная гипергидратация, объем-натрий зависимая гипертония, застойная сердечная недостаточность.
Потеря натрия (обессоливание) обусловлена нарушением способности почек к реабсорбции натрия. Симптомы потери натрия следующие: жажда, слабость, снижение тургора кожи; ортостатическая гипотония; повышение гематокрита и общего белка сыворотки.
Синдром потери натрия характерен для тубуло-интерстициальных поражений почек (поликистоз, аналгетическая нефропатия, пиелонефрит и хронический тубулоинтерстициальный нефрит), а также для старческой почки.
Гиперкалиемия. Способность почек к поддержанию нормальной концентрации калия крови длительно сохраняется и утрачивается лишь при снижении СКФ ниже 15 – 20 мл/мин. Терминальная гиперкалиемия (уровень калия крови более 7 мэкв/л), требует срочного гемодиализа. При тяжелой гиперкалиемии (более 7,5 мэкв/л) клетки теряют способность к возбудимости, что проявляется мышечными параличами, острой дыхательной недостаточностью, диффузным поражением ЦНС, брадикардией, атриовентрикулярной блокадой вплоть до полной остановки сердца.
Нарушение фосфорно-кальциевого обмена
Отмечается гиперфосфатемия в сочетании с гипокальциемией. Стойкая выраженная гиперфосфатемия в сочетании с повышенным уровнем паратиреоидного гормона, зудом и симптомами остеодистрофии характерна для вторичного гиперпаратиреоза. Бывает и гипофосфатемия, которая обусловлена синдромом нарушенного всасывания, длительным употреблением фосфорсвязывающих антацидов, гипервентиляцией, авитаминозом D. Персистирующая гипофосфатемия приводит к снижению сократительной способности миокарда, усугублению метаболического ацидоза и уремического иммунодефицита.
Нарушение кислотно-основного баланса
Сначала обнаруживается компенсированный гиперхлоремический ацидоз с умеренным снижением бикарбонатов крови вследствие дефекта их тубулярной реабсорбции и снижения секреции аммиака. В терминальную стадию присоединяется метаболический ацидоз с высоким анионным дефицитом вследствие задержки сульфатов, фосфатов и других кислот. При декомпенсированном метаболическом ацидозе (со снижением pH крови) присоединяется дыхание Куссмауля, другие признаки диффузного поражения ЦНС, что требует гемодиализа.
Нарушения азотистого баланса
Стойкое увеличение уровня азотистых шлаков (креатинина, азота мочевины, мочевой кислоты) крови наблюдается при снижении СКФ ниже 40 мл/мин.
Из всех показателей азотистого обмена креатинин крови наиболее специфичен для диагностики почечной недостаточности.
К клиническим проявлениям нарушений азотистого баланса, присоединяющимся на поздней стадии почечной недостаточности, относят: уремический энтероколит, вторичную подагру, запах аммиака изо рта.
Поражение сердечно-сосудистой системы
Артериальная гипертония одно из наиболее частых проявлений ХБП. Обнаруживается в терминальной стадии – у 90% больных.
Объем-натрийзависимая (гиперволемическая) гипертония вследствие почечной задержки натрия и воды развивается в 95% случаев почечной гипертонии. Такая гипертония поддается лечению путем удаления избытка соли и жидкости (диетой, диуретиками, гемодиализом).
В 5% — наблюдается более тяжелая гипертония. Она вызвана активацией ренин-ангиотензин-альдостероновой системой (РААС) – ренинзависимая гипертония. Этот вид гипертонии часто приобретает черты злокачественности с тяжелым поражением сосудов глазного дна, ЦНС, миокарда.
Перикардит, как правило, присоединяется в терминальной стадии уремии. Проявляется шумом трения перикарда, болевым синдромом, расширением границ сердца при появлении выпота. Уремический перикардит требует срочного гемодиализа.
Застойная сердечная недостаточность формируется при тяжелой уремии, вследствие уремической (диализной) кардиомиопатии. Клиника напоминает проявление тяжелого миокардита: расширение всех отделов сердца, ритм галопа, диффузные изменения ЭКГ, аритмии, левожелудочковая недостаточность.
Тяжелые аритмии бывают как при гиперкалиемии, так и при гипокалиемии.
Поражение системы кроветворения
По мере прогрессирования ХБП частота выявления анемии возрастает. По мере сморщивания почек снижается почечный синтез эритропоэтина. Почечная анемия нормоцитарная, нормохромная.
Поражение легких
Уремический интерстициальный отек легких самое тяжелое поражение легких при ХБП. Важно отличать уремический интерстициальный отек – «водяное легкое» от кардиогенного отека легких, вследствие острой левожелудочковой недостаточности (при инфаркте миокарда, кардиомиопатии, гипертоническом кризе) и от острой дыхательной недостаточности при респираторном дистресс синдроме. Бактериальная пневмония, чаще стафилококковая, также нередко осложняет почечную недостаточность.
Поражение органов желудочно-кишечного тракта
При уремии бывает анорексия, постоянная тошнота, рвота, стоматит, паротит. Наиболее тяжелые проявления уремии – эрозивные поражения ЖКТ (язвенный эзофагит, эрозивный гастрит, пептические язвы желудка и двенадцатиперстной кишки, геморрагический энтероколит) опасные массивные желудочно-кишечными кровотечениями. Частое заболевание ЖКТ больных на гемодиализе – вирусный гепатит.
6. Классификация
У пациентов с наличием заболеваний, вызывающих повреждение почек, или признаками повреждения почек оценивают СКФ и соответствующую стадию ХБП (таблица 3).
Показатель СКФ на уровне 90 мл/мин принят как нижняя граница нормы. Состояния со СКФ в диапазоне от 60 до 89 мл/мин при отсутствии признаков повреждения почек классифицируют как «снижение СКФ», которое целесообразно отразить в диагнозе. Легкое снижение СКФ у пожилых лиц без инициирующих факторов риска ХБП расценивается как возрастная норма.
Когда в течение 3 и более месяцев СКФ не достигает 60 мл/мин независимо от того, имеются ли при этом другие признаки нефропатии, следует диагностировать ХБП соответствующей стадии.
Таблица 3. Классификация хронической болезни почек (K/DOKI, 2006)
| Стадия | Характеристика | СКФ мл/мин/
1,73 м² |
Мероприятия |
| I | повреждение почек с нормальной или повышенной СКФ | ≥ 90 | диагностика и лечение основного заболевания, замедление темпов снижения СКФ, снижение риска ССЗ |
| II | повреждение почек с легким снижением СКФ | 60 – 89 | + оценка скорости прогрессирования |
| III | умеренное снижение СКФ | 30 — 59 | + выявление и лечение осложнений |
| IV | выраженное снижение СКФ | 15 — 29 | + подготовка к заместительной терапии |
| V | почечная недостаточность | < 15 | почечная замест. терапия |
7. Формулировка диагноза
Концепция ХБП расширяет понятие «хроническая почечная недостаточность» за счет оценки начальных стадий заболеваний почек, что позволяет начать превентивные мероприятия раньше, замедлить прогрессирование ПН и снизить нарастающую частоту терминальной ПН.
Поскольку нынешняя Международная классификация болезней (МКБ) была рекомендована для использования в 1994 году, то соответственно в официальном русском переводу классификации нет рубрики ХБП. Однако в октябре 2007 года Всемирная организация здравоохранения существенно уточнила рубрику N 18 (таблица 4).
В целях сохранения общепринятой структуры диагноза рекомендуется диагноз ХБП указывать после основного заболевания. Кодировка болезни устанавливается в соответствии с МКБ по основному заболеванию, а при невозможности выявления последнего – рубриками N 18.1-9.
Таблица 4. Уточненная кодировка рубрики N 18 в МКБ (WHO, 2007).
| Код | Описание |
| N18 | Хроническая болезнь почек
Включено:хроническая уремия, диффузный склерозирующий гломерулонефрит Исключено:хроническая почечная недостаточность с гипертензией (12.0). Используйте дополнительный код, если необходимо, для идентификации основного заболевания Используйте дополнительный код, если необходимо, для идентификации гипертензии |
| N18.1 | Хроническая болезнь почек, стадия 1
Повреждение почек с нормальной или повышенной СКФ (> 90 мл/мин) |
| N18.2 | Хроническая болезнь почек, стадия 2
Повреждение почек с легким снижением СКФ (60 – 89 мл/мин) |
| N18.3 | Хроническая болезнь почек, стадия 3
Повреждение почек с умеренным снижением СКФ (30 – 59 мл/мин) |
| N18.4 | Хроническая болезнь почек, стадия 4
Болезнь почек с выраженным снижением СКФ (15 – 29 мл/мин) |
| N18.5 | Хроническая болезнь почек, стадия 5
Включено:хроническая уремия, терминальная стадия болезни почек |
| N18.9 | Хроническая болезнь почек, неуточненная
Включено:почечная недостаточность неуточненная, уремия неуточненная Исключено: почечная недостаточность с гипертензией (12.0) |
Примеры некоторых распространенных клинических диагнозов приведены в таблице 5.
Необходимо помнить, что при отсутствии признаков повреждения почек и СКФ 60-89 мл/мин стадия ХБП не устанавливается, а в диагнозе отмечается «снижение СКФ». У пожилых лиц (>65 лет) показатели СКФ в пределах 60-89 мл/мин расцениваются как вариант нормы.
Таблица 5. Примеры формулировок клинического диагноза
| Диагноз | МКБ |
| Хронический. гломерулонефрит, мочевой синдром, ХБП 2 стадия. | NO3.9 |
| Хронический. гломерулонефрит, мембранозно-пролиферативный, нефротический синдром, обострение, ХБП 3 стадия. | NO3.5 |
| Сахарный диабет 2 типа, тяжелое течение, декомпенсация.
Осложнение: Диабетическая нефропатия, ХБП 4 стадия. |
Е11.2 |
| Гипертоническая болезнь III стадии, риск 4.
Осложнения: Хроническая сердечная недостаточность 1 ФК, 1 стадия. Снижение СКФ (64 мл/мин, 25.04.08). |
I13 |
| Гипертоническая болезнь II стадия, 2 степень, риск 3.
Осложнение: ХБП 2 стадия. |
I12.0 |
| Системная красная волчанка, подострое течение, активность II степени, полиартрит, правосторонний экссудативный плеврит, мембрано-пролиферативный гломерулонефрит, ХБП 4 стадия. | М32 |
| Хронический тубулоинтерстициальный нефрит, вызванный парацетамолом, ХБП 2 стадия. | N14 |
| Хроническая болезнь почек, неуточненная, 4 стадия. | N18.9 |
8. Маркеры повреждения почек
Хроническое повреждение почек определяется как структурные аномалии почек, которые могут привести к снижению почечной функции.
Экспертами предложены лабораторные и визуальные маркеры повреждения почек, используемые для постановки диагноза ХБП (К/DOQI, 2002). К лабораторным маркерам относятся протеинурия, гематурия, лейкоцитурия, цилиндрурия.
Протеинурия является ранним и чувствительным маркером почечного повреждения при многих нефропатиях. При этом основным белком мочи, как правило, является альбумин с малым молекулярным весом (таблица 6).
Альбуминурия. В норме у взрослых экскреция альбумина с мочой составляет <30 мг/сут. Микроальбуминурия (30 – 300 мг/сут) является ранним маркером повреждения почек.
Соотношение концентрации белка (альбумина) к концентрации креатинина в одной и той же порции мочи. Такая оценка устраняет влияние изменения концентрации мочи, которые в равной мере воздействуют на концентрацию в моче белка и креатинина. Установлено, что величина отношения концентрации белка к концентрации креатинина в первой утренней порции мочи наиболее тесно коррелирует с уровнем ночной протеинурии, тогда как его значения в середине первой половины дня более отражают суточную протеинурию.
Визуальные маркеры повреждения почек определяются при инструментальном исследовании:
- ультразвуковое исследование – изменение размеров почек, повышение эхогенности, объемные образования, камни, нефрокальциноз, кисты
- компьютерная томография – обструкция, опухоли, кисты, камни пузыря и мочеточников, стеноз a. renalis
- изотопная сцинтиграфия – асимметрия функции, размеров почек
Таблица 6. Оценка протеинурии и альбуминурии (K/DOKI, 2006).
| Показатель | Исследование мочи | Норма | Микроальбу-
минурия |
Альбуминурия/
протеинурия |
||
| Белок | 24-часовая экскреция | <300 мг/сут | —— | >300 мг/сут | ||
| произвольная порция — полоска |
<30 мг/г | —— | >30 мг/дл | |||
| белок/креатинин в произвольной порции |
<200 мг/г | —— | >200 мг/г | |||
| Альбу-мин | 24-часовая экскреция | <30 мг/сут | 30-300 мг/сут | >300 мг/сут | ||
| произвольная порция — полоска |
<3 мг/дл | >3 мг/дл | ||||
| альбумин/креатинин в произвольной порции |
м | <17 мг/г | 17-250 мг/г | >250 мг/г | ||
| ж | <25 мг/г | 25-355 мг/г | >355 мг/г | |||
Повреждение почек может проявляться также клинико-лабораторными синдромами:
- нефротический синдром – протеинурия > 3.5 г/сут, гипоальбуминемия, гиперлипидемия, отеки
- нефритический синдром – гематурия, эритроцитарные цилиндры, протеинурия >1.5 г/сут, отеки, АГ
- тубулоинтерстициальный синдром – снижение плотности мочи, электролитные нарушения, протеинурия <1.5 г/сут.
9. Оценка функции почек
В общетерапевтической практике функция почек обычно оценивается с помо-щью следующих методов:
Скорость клубочковой фильтрации
- расчетные формулы
- клиренс креатинина
креатинин плазмы крови
цистатин С
Скорость клубочковой фильтрации. Как показатель функционального состояния почек.
Для быстрой оценки и мониторинга функции почек рекомендуют оценивать величину СКФ, которая отражает функциональное состояние почек. Между уровнем СКФ и наличием тех или иных проявлений или осложнений ХБП существует тесная связь.
Необходимо отметить, что использование СКФ, как основной меры тяжести ХБП, а не более привычного многим практическим врачам сывороточного креатинина, предпочтительнее, т.к. взаимоотношения между концентрацией креатинина и СКФ не линейны. Поэтому на ранних стадиях хронических заболеваний почек, при очень близких значениях уровней сывороточного креатинина, величины СКФ могут различаться почти в два раза. В этой связи СКФ следует рассматривать как гораздо более чувствительный показатель функционального состояния почек.
При хронических нефропатиях снижение СКФ отражает уменьшение числа действующих нефронов, то есть является показателем сохранности массы функционирующей почечной паренхимы. В широкой практике используют простые расчетные методы оценки СКФ (табл. 7)
Таблица 7. Расчетные формулы оценки СКФ
| Вариант | Формула |
| Cockroft-Gault (мл/мин) | 1.228*[140 — возраст]*вес тела (кг)*0.85 (для женщин) |
| креатинин плазмы (мкмоль/л) | |
| MDRD (мл/мин/1.73 м2 | 32788*[креатинин плазмы (мкмоль/л)] )–1.154 *возраст–.203*
0.742 (для женщин) |
| Площадь тела (м2) | 0.007184×рост (см) 0.725×вес (кг)0.425
используется для стандартизации СКФ в формуле Cockroft-Gault: (СКФ/площадь тела)*1.73 |
В целом расчетная СКФ менее надежна в 1 –2 стадиях ХБП, когда возможны гиперфильтрация и гипертрофия действующих нефронов, что и поддерживает нормальный уровень суммарной СКФ. Среди методов расчета СКФ предпочтение отдают формуле MDRD, которая не требует оценки веса тела и надежнее оценивает 3 – 5 стадию ХБП, по сравнению с формулой Кокрофта-Голта. Точность формулы MDRD у 90% пациентов находится в пределах ±30% измеренной СКФ.
Оценка СКФ по клиренсу креатинина (лучше инулина, который не секретируется канальцами) предпочтительнее, чем вышеописанные расчетные формулы, в начальных стадиях ПН, при быстром изменении функции почек, кахексии или ожирении, заболеваниях мышц, параплегии, диете с ограничением или избытком креатинина, приеме нефротоксичных препаратов, диализе.
Креатинин плазмы крови.Общепринятая оценка нормы креатинина плазмы крови отсутствует. Уровень креатинина существенно зависит от пола (у женщин на 15% ниже), раса, веса тела, хронических заболеваний, диеты (вегетарианцы или обильное употребление мяса) и это снижает диагностическую ценность метода.
Цистатин С –ингибитор цистеин-протеазы, вырабатываемый всеми ядросодержащими клетками и поступающий в кровоток с постоянной скоростью. Низкий молекулярный вес позволяет свободно фильтроваться в клубочках, далее цистеин С практически полностью реабсорбируется без канальцевой секреции и катаболизируется.
10. Лечение
Основная цель лечения пациентов с ХБП — замедление темпов прогрессирования ПН и отдаление времени начала заместительной почечной терапии. Достижение этой цели требует проведения целого комплекса мероприятий:
- контроль уровня гипертензии с достижением АД < 130/85 мм рт. ст.
- применение ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов ангиотензина II (БРА)
- контроль гликемии у пациентов с диабетом (HbAIc <7.0%)
- отказ от курения
Широко используют иАПФ, которые снижают внутриклубочковую гипертензию и гиперфильтрацию, расширяя выносящие артериолы клубочков. Длительное лечение иАПФ позволяет сохранить фильтрационную функцию почек, замедлить темпы снижения СКФ, независимо от наличия АГ. Препараты оказались эффективными даже при тяжелой ХБП с уровнем креатинина 440 – 530 мкмоль/л. В случае непереносимости ИАПФ рекомендуют БРА. Комбинация ИАПФ и БРА, по-видимому, в большей степени снижает протеинурию, чем каждый препарат в отдельности (Kunz R. et al, 2008).
При недиабетической ХБП препараты, блокирующие ренин-ангиотензиновую систему, эффективны при протеинурии >0.5 г/сут (K/DOQI, 2004; UK Renal Association, 2007). ИАПФ и БРА замедляют прогрессирование диабетической ХБП с микроальбуминурией даже при отсутствии АГ (RENAAL, IDNT, CSG trial of Captopril).
После начала лечения ИАПФ отмечают повышение креатинина плазмы, коррелирующее с замедлением прогрессирования ХБП. Лечение ИАПФ можно продолжить при снижении СКФ <30% от исходного в течение 4 мес после начала лечения и гиперкалиемии ≤5.5 ммоль/л (K/DOQI, 2006).
Низкобелковая диета (0.6-0.8г/кг) назначается при 3 – 4 стадиях ХБП и помогает снизить фильтрационную нагрузку почки.
Пациенты с ХБП, в том числе на 5 стадии, чаще всего умирают от сердечно-сосудистых заболеваний. Более того, ХБП является большим фактором риска сердечно-сосудистых катастроф. Поэтому уже на ранних стадиях ХБП необходимо проводить активное лечение дислипидемии, АГ, ожирения, отказаться от курения и увеличить физические нагрузки.
ХБП относится к большим факторам риска сердечно-сосудистых заболеваний. При дислипидемии с повышенным уровнем холестерина липопротеинов низкой плотности показано назначение статинов. Возможно статины замедляют прогрессирование ХБП. Целью лечения – достижение уровня холестерина липопротеинов низкой плотности <2.6 ммоль/л.
Недигидропиридиновые антагонисты кальция, сулодексид и статины не имеют достаточно надежных доказательств эффективного замедления темпов снижения СКФ.
У пациентов с ХБП повышен риск острого снижения СКФ при приеме нестероидных противовоспалительных препаратов (включая селективные), аминогликозидов, циклоспорина, ванкомицина, внутривенном введении рентгенконтрастных веществ.
Синдромальное лечение
Артериальная гипертензия
Коррекция АД замедляет наступление терминальной ПН и снижает риск сердечно-сосудистых заболеваний. Важное значение имеет ограничение соли в диете. Целью антигипертензивной терапии является поддержание АД на уровне ≤130/85 мм рт. ст. В случае протеинурии > 1 г/сут есть основание считать целевым АД 125/75 мм рт. ст. В то же время снижение АД <110 мм рт.ст. может увеличить прогрессирование ХБП (AIPRD; K/DOQI, UK Renal Association, 2007).
На стадии ПН, как правило, монотерапия не приводит к стабилизации уровня АД, поэтому рекомендуется комбинированная терапия антигипертензивными препаратами, относящимися к различным группам. Наряду с ИАПФ и БРА можно назначить бета-блокаторы, диуретики, альфа-блокаторы, антагонисты кальция. Необходимо учитывать коррекцию дозы препаратов, выводящихся почками.
Гипергликемия
Диабетическая нефропатия развивается у 20 – 40% пациентов с диабетом в среднем через 5 – 7 лет после появления признаков протеинурии. Диабетическая нефропатия является ведущей причиной терминальной почечной недостаточности (40 – 50% всех случаев), при которой проводится диализ или трансплантация почки. В этой связи ежегодно проводят контроль альбуминурии и СКФ у пациентов с диабетом 1 типа через 5 лет от начала заболевания, а с диабетом 2 типа – сразу после установления диагноза.
Хороший контроль гликемии снижает риск и замедляет развитие диабетической нефропатии (DCCT, UKPDS). Однако эффективность интенсивного контроля гликемии при нефропатии с выраженной протеинурией не доказана.
На ранних стадиях диабетической нефропатии возможно продолжение лечения пероральными сахароснижающими препаратами, а на поздних – предпочтительнее инсулинотерапия. Цель лечения диабета – достижение уровня гликированного гемоглобина (HbAIc )<7.0%.
Отеки
При отеках необходим регулярный контроль веса утром после туалета. Рекомендуется диета с ограничением соли <2.4 г/сут.
Для устранения задержки жидкости применяют тиазидовые диуретики однократно при 1 – 3 стадиях ХБП, петлевые диуретики 1 – 2 раза в сутки при 4 – 5 стадиях. При выраженных отеках возможна комбинация тиазидовых и петлевых диуретиков. У пациентов со СКФ <30 мл/мин калийсберегающие диуретики могут быть опасны вследствие гиперкалиемии.
При нефротическим синдроме, несмотря на массивную потерю белка, содержание в пище белка животного происхождения не должно превышать 0,8 г/кг. При снижении концентрации альбумина в крови <2.5 г/л рекомендуют инфузии бессолевого альбумина1гкг*сут.
Анемия
Анемия часто наблюдается у больных ПН, ассоциируется с повышенной смертностью, вызывает ухудшение течения сопутствующих заболеваний (ишемическая болезнь сердца, сердечная недостаточность) и снижает качество жизни.
Частично причиной анемии может быть дефицит железа, связанный с укорочением жизни эритроцитов, нарушением всасывания, кровопотерей. На додиализной стадии уровень ферритина <25 мг/л у мужчин и <12 мг/л у женщин свидетельствует о вкладе дефицита железа в развитии анемии. Для лечения применяют препараты железа из расчета 200мг элементарного железа в сутки в течение 6 месяцев.
Выраженная анемия связана со сниженным синтезом почечного эритропоэтина – гормона, обеспечивающего эритропоэз. При назначении эритропоэтина нужно тщательно взвесить риск (неконтролируемая АГ, гиперкалиемия, тромбозы) и пользу (повышение качества жизни, отказ от гемотрансфузий).
На фоне лечения эритропоэтином усиливается дефицит железа сыворотки крови, поэтому для более эффективного лечения терапию эритропоэтином целесообразно сочетать с применением желесосодержащих препаратов.
При неконтролируемой АГ и выраженной ишемической болезн сердца лечение эритропоэтином противопоказано. Цель лечения анемии – достижение уровня гемоглобина 110 – 120 г/л (K/ DOQI, 2007).
Метаболические нарушения
Развитие ПН характеризуется развитием гиперкалиемии вследствие снижения почечной экскреции калия. Поэтому рекомендуется исключение из питания продуктов, богатых калием (бананы, курага, цитрусовые, изюм, картофель). В тех случаях, когда гиперкалиемия угрожает полной остановкой сердца (>6.5 ммоль/л) вводят внутривенно в течение 5 минут 10 мл 10% раствор глюконата кальция или 10 ед инсулина в 60 мл 40% глюкозы или бикарбонат натрия 8.4% 40 мл.Наиболее эффективен для устранения жизнеопасной гиперкалиемии гемодиализ.
При гиперфосфатемии ограничивают продукты, богатые фосфором (рыба, сыр, гречка), вводят препараты, связывающие фосфор в кишечнике (карбонат кальция). Для лечения гипокальциемии и профилактики гиперпаратиреоза назначают карбонат кальция 0.5 – 1 г внутрь 3 раза в сутки с едой, а при неэффективности — активные метаболиты витамина D (кальцитриол). В случае развития гиперпаратиреоза (гиперкальциемия, повышение щелочной фосфотазы, кальциноз сосудов) назначают активные метаболиты витамина D, при необходимости удаляют гиперплазированные паращитовидные железы.
Уремия
Энтеросорбенты способны в небольшой степени связывать токсические продукты в кишечнике и выводить их из организма. В качестве энтеросорбентов можно использовать энтеродез, полифепан. При использовании энтеросорбентов необходимо помнить, что их назначают натощак и через 1,5 – 2 часа после приема основных лекарственных препаратов. Важно следить за регулярностью действия кишечника, при необходимости – назначать слабительные средства (лактулоза) или производить очистительные клизмы.
При СКФ <15 мл/мин требуется ограничение животного белка до 0.6г/кг массы тела. Только в случае сочетания ХБП и нефротического синдрома допустимо потребление белка в объеме 0.8г/кг массы тела.
При соблюдении низкобелковой диеты у больных пониженного питания могут возникнуть проблемы, связанные с катаболизмом собственных белков. В этих случаях рекомендуются кетоновые аналоги аминокислот (кетостерил), которые в организме ферментативно преобразуются в соответствующие L-аминокислоты, расщепляя при этом мочевину.
Лечение экстракорпоральное
В настоящее время существуют три метода заместительной терапии больных, имеющих терминальную стадию ПН: гемодиализ, перитонеальный диализ и трансплантация почки. Экстракорпоральное лечение показано при 5 стадии ХБП, характеризующейся СКФ <15 мл/мин (K/DOQI, 2006; ERA, 2002). В случаях гиперкалиемии, резистентных отеков, гиперфосфатемии, гипер- или гиповолемии, метаболического ацидоза, анемии, неврологических нарушений (энцефалопатия, нейропатия), потери веса, перикардита, плеврита, гастроинтестинальных симптомов, стойкой АГ заместительную терапию можно начинать при СКФ >15 мл/мин. Нежелательно откладывать лечение до состояния с СКФ <6 мл/мин.
Гемодиализ является наиболее распространенным методом заместительной терапии. Этот аппаратный метод очищения крови проводится 3 раза в неделю и требует постоянного прикрепления пациента к диализному центру. В настоящее время развиваются методы диализа на дому с помощью портативных устройств и мобильных медицинских бригад.
Подготовка к гемодиализу начинается у пациентов с прогрессирующей ХБП уже на 4 стадии и проводится специалистом. До начала гемодиализа необходима коррекция анемии, нарушений кальциевого и фосфорного обмена, иммунизация против вирусного гепатита В. Начало диализа на более ранних стадиях позволяет добиться снижения заболеваемости и летальности (CANUSA).
Перитонеальный диализ не требует стационарного лечения и сосудистого доступа, обеспечивает более стабильные показатели системной и почечной гемодинамики. Проводится ежедневно несколько раз в сутки.
Трансплантация почки является наиболее эффективным методом заместительной терапии, позволяет добиться полного излечения на период функционирования трансплантанта и обеспечивает лучшую выживаемость, по сравнению с диализом.
Вместе с тем, трансплантация почки требует оперативного вмешательства, лечения цитостатиками, нередко осложняется инфекциями и достаточно дорогая.
Тактика ведения
В лечении пациентов с ХБП участвуют терапевты, нефрологи, специалисты по заместительной терапии. Общий план ведения пациентов с ХБП на разных стадиях представлен в таблицах 8 и 9. Терапевт в поликлинике или стационаре проводит скрининг ХБП у пациентов, которые имеют:
- сахарный диабет
- АГ
- сердечную недостаточность
- атеросклероз коронарных, церебральных или периферических сосудов
- неясную анемию
- семейный анамнез терминальной ПН
Таблица 8. Диагностические мероприятия при ХБП (K/DOQI, 2006, с изменениями).
| Стадии | Анализы | Частота |
| 1 — 2 | АД, СКФ, липидограмма, микроальбуминурия/протеинурия | ежегодно |
| 3 | +калий, натрий, кальций, фосфор, мочевая кислота, глюкоза плазмы, Hb | Через 6 мес, при стабильном течении* — ежегодно |
| 4 — 5 | +паратгормон, бикарбонат | Через 3 мес, при стабильном течении* 4 ст. – через 6 мес |
Примечание. * — снижение СКФ <2 мл/мин за 6 мес.
Таблица 9. тактика ведения ХБП (K/ DOQI, 2006).
| Стадии | План действий |
| 1 — 2 | Коррекция сердечно-сосудистых факторов риска (АГ, дислипидемия, курение, ожирение, гипергликемия, низкая физическая активность) |
| 3 | СКФ каждые 3 месяца
ИАПФ и/или БРА Избегать нефротоксичных препаратов Коррекция дозы медикаментов |
| 4 | Консультация нефролога
Подготовка к диализу или трансплантации |
| 5 | Диализ или трансплантация |
У пациентов с впервые выявленной СКФ 30 – 60 мл/мин/1.73 м2 рекомендуется оценить стабильность снижения функции почек. Повторная оценка проводится через 2 – 4 недели и далее через 3 – 6 месяцев. У многих пациентов не отмечается быстрого прогрессирования болезни почек.
Консультация нефролога целесообразна в следующих случаях (ERA, 2002; СCSN, 2006; CARI, 2007):
- СКФ <30мл/мин/1.73 м2 (ХБП на стадии 4 – 5)
- СКФ 30 – 60 мл/мин/1.73 м2 с быстрым снижением функции почек или клиническими признаками, свидетельствующими о риске быстрого снижения функции почек:
- прогрессирующее снижение СКФ (>15% за 3 месяца)
- протеинурия >1г/сут
- выраженная и неконтролируемая АГ
- тяжелые сопутствующие заболевания
- анемия <110 г/л
Нефролог уточняет диагноз и функцию почек и при необходимости направляет на заместительную почечную терапию. При СКФ <15 мл/мин или других вышеописанных показаниях для проведения гемодиализа необходимо направить пациента в городское отделение гемодиализа.
Литература
- Алгоритм специализированной медицинской помощи больным сахарным диабетом. М 2006.
- Бабков Б.Т., Томилина Н.А. Состояние заместительной терапии с хронической почечной недостаточностью в Российской Федерации в 1998-2005 годах. Нефрология и диализ 2007; 9:6-85.
- ВНОК/РМОАГ. Диагностика и лечение артериальной гипертонии.2008.
- A report with consensus statements of the International Society of Nephrology 2004 Consensus Workshop on Prevention of Progression of Renal Disease, Hong Kong, June 29, 2004. Kidney Int Suppl 2005; 94: S2-S7.
- American Diabetes Association: Standarts of Medical Care in Diabetes. 2008.
- KDOQI Clinical Practice Guidelines and Clinical Practice Recommendation for Diabetes and Chronic Kidney Disease. AJKD 2007; 49: S1-S179.
- KDOQI Clinical Practice Guidelines and Clinical Practice Recommendation for Anemia In Chronic Kidney Disease: 2007 Update Of Hemoglobin Target.
- UK Renal Association Clinical Practice Guidelines for the Care of Patients with Chronic Kidney Disease 2007.
