Хронический гастрит. Функциональная диспепсия
Содержание страницы
1. Анатомия и физиология желудка
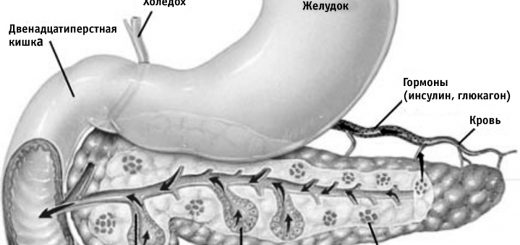
Желудок— орган пищеварительной системы, граничащий в своей верхней (начальной) части с пищеводом, а в нижней — с двенадцатиперстной кишкой (ДПК).
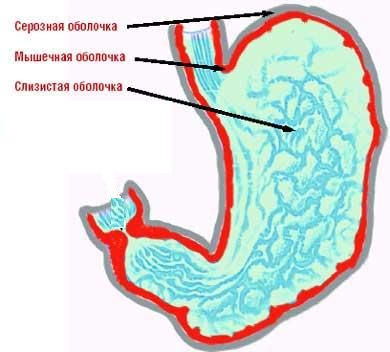
Рисунок 1. Строение желудка.
Желудок выполняет в организме человека многообразные функции. К ним относятся физическая и химическая обработка пищи, ее депонирование и эвакуация, выработка гастромукопротеина (внутреннего фактора Кастла), необходимого для всасывания в кишечнике витамина В12. Желудок участвует в обмене веществ, выделяя некоторые продукты метаболизма. Однако с позиций клинической гастроэнтерологии наиболее важными представляются кислото- и пепсинообразующая, слизеобразующая и моторно-эвакуаторная функции желудка, а также синтез в нем простагландинов и некоторых гастроинтестинальных гормонов. Нарушения этих функций могут играть существенную роль в развитии ряда распространенных заболеваний. Кроме того, нормализация указанных функций в случаях их нарушения является, как правило, составной частью проводимой лекарственной терапии.
Желудок расположен в верхней части брюшной полости. Форма и объем желудка не постоянны. Они изменяются в зависимости от состояния его мышечного тонуса, его наполнения, фазы пищеварения, положения тела, а также от состояния близлежащих органов. Условно различают 4 части желудка: кардиальную, тело желудка, дно (свод) и привратниковую (пилорическую) часть, которую, в свою очередь, подразделяют на антральную (привратниковая пещера) и канал привратника. ДПК непосредственно примыкает к желудку и является начальным отделом тонкой кишки. У здорового взрослого человека ДПК имеет длину в среднем 30 см, чаще подковообразной формы. Выделяют 4 части ДПК: верхнюю, или луковицу, нисходящую, нижнюю горизонтальную и восходящую. В нисходящей находится фатеров сосочек (большой сосочек ДПК), который образуется из слияния общего желчного и панкреатического протоков, и малый сосочек, на котором открывается добавочный проток поджелудочной железы. Нижняя горизонтальная часть покрыта брюшиной и соприкасается с нижней полой веной, аортой и поджелудочной железой. Восходящая часть переходит в тонкую кишку.
Стенку желудка образует слизистая оболочка желудка, подслизистый слой (подслизистая основа), мышечная и серозная оболочки. Слизистая оболочка желудка состоит из однослойного цилиндрического эпителия, собственного слоя, представленного рыхлой соединительной тканью, и мышечной пластинки. В собственной пластинке имеются трубчатые желудочные железы, в которых выделяют 3 вида клеток; главные, секретирующие пепсиногены и химозин; париетальные (обкладочные), секретирующие НС1 и гастромукопротеин; добавочные клетки (мукоциты), секретирующие мукоидный секрет. В железах привратника находятся гормонально-активные клетки, выделяющие гастрин и др.
Хлористоводородная кислота выделяется париетальными (обкладочными) клетками слизистой оболочки желудка, число которых у здорового человека составляет примерно 1 биллион (109). Секреция кислоты париетальной клеткой осуществляется по принципу «кислотного насоса», в котором К+ обменивается на Н+, а С1— — на НСО—3. Важную роль в этом процессе играет Н+К+-АТФаза, которая, используя энергию, выделяющуюся при расщеплении АТФ, обеспечивает транспорт Н+ из париетальной клетки и их обмен на К+.
Слизистая оболочка ДПК покрыта цилиндрическим эпителием, имеет ворсинки, между которыми находятся кишечные крипты, в них открываются слизистые дуоденальные (бруннеровы) железы, продуцирующие вязкий щелочной секрет. В слизистой оболочке содержатся также эндокринные клетки (клетки Кульчицкого), вырабатывающие гастроинтестинальные гормоны (секретин, холецистокининин.). ДПК вместе с желудком, поджелудочной железой, печенью и ее желчевыводящим аппаратом (билиарная система) играет важную роль в обеспечении секреторной, моторной и эвакуаторной функции пищеварительного тракта.
Образование кишечных ферментов в самой ДПК начинается в криптах, а продолжается и заканчивается на поверхности ворсинок слизистой оболочки, т.е. вся слизистая ДПК является железистым аппаратом. Слизистая оболочка ДПК продуцирует киназиноген, активирующий энтерокиназу, которая превращает трипсиноген (профермент) в трипсин (активный фермент), выделяет секретин, возбуждающий секрецию поджелудочной железы, желчеобразовательную функцию печени, желчевыделение и другие гормоны. Секреторная деятельность желудка и ДПК регулируется нервными и гуморальными механизмами.
Желудку и ДПК свойственны тонические, перистальтические, маятникообразные сокращения и ритмическая сегментация.
На фоне болезней и, очевидно, возрастной эволюции в слизистой оболочке желудка и ДПК возникают атрофические изменения, сопровождающиеся снижением гормональной и ферментной активности желудка и ДПК.
В формировании так называемого защитного слизистого барьера важное значение имеет непрерывная секреция желудочной слизи. При этом разрушенные гликопротеиды восстанавливаются за счет их синтеза постоянно обновляющимися слизеобразующими клетками. Стимулирующее влияние на выработку оказывают возбуждение адрено- и холинергических рецепторов, инсулин, серотонин, простагландины, секретин, местное механическое раздражение слизистая оболочка желудка. Тормозящее действие на образование и выделение слизи оказывают некоторые лекарственные препараты (ацетилсалициловая кислота и др.). Желудочная слизь, покровный эпителий, бикарбонаты, простагландины и другие факторы формируют защитный барьер слизистой оболочки, который оказывается несостоятельным, главным образом в связи с активным воспалением.
2. Функциональная диспепсия
Определение: Синдром функциональной диспепсии определяется как симптомокомплекс, относящийся к гастродуоденальной области, при отсутствии каких-либо органических, системных или метаболических заболеваний, которые могли бы объяснить эти проявления (Римские критерии IIΙ, 2006). Больные, имеющие один или более из следующих симптомов (чувство полноты после еды, быстрая насыщаемость, эпигастральная боль или жжение) определяются как больные диспепсией.
Согласительное совещание Международной рабочей группы по совершенствованию диагностических критериев функциональных заболеваний желудочно-кишечного тракта (Римские критерии IIΙ, 2006) дало подробное определение каждого из симптомов, входящих в данный синдром (табл. 1).
Таблица 1. Симптомы, входящие в синдром диспепсии, и их определение
| Симптомы | Определение |
| Эпигастральная боль | Эпигастрием считается область между пупком и нижним концом грудины, сбоку отграничивающаяся среднеключичными линиями. Боль определяется как субъективное неприятное ощущение, некоторые пациенты могут ощущать боль как повреждение тканей. Другие симптомы могут быть чрезвычайно беспокоящими, но не восприниматься пациентом как боль |
| Жжение в эпигастральной области | Жжение, воспринимаемое как неприятное субъективное ощущение жара, локализованное в эпигастрральной области |
| Чувство полноты после еды | Неприятное ощущение, подобное длительному ощущению нахождения пищи в желудке |
| Раннее насыщение | Ощущение быстрого наполнения желудка после начала еды, непропорционально объему съеденной пищи, в связи с чем невозможно съесть пищу до конца. Ранее использовался термин «ранняя насыщаемость satiety», но насыщение (satiation) является более корректным термином для отражения состояния исчезновения ощущения аппетита во время еды |
Эпидемиология. Примерно 20─30 % населения постоянно или периодически испытывают диспептические симптомы. При этом, как показали исследования, меньшая часть (35 – 40%), приходится на группу заболеваний, входящих в группу органической диспепсии, а большая часть (60 – 65%) – на долю функциональной диспепсии (ФД). На основании проспективных исследований установлено, что впервые появляются жалобы примерно у 1 % населения в год. Наличие диспептических жалоб существенно снижает качество жизни таких больных.
В большинстве случаев диспептические симптомы наблюдаются длительное время, хотя возможны периоды ремиссии. Примерно каждый второй пациент с диспепсией рано или поздно обращается за медицинской помощью в течение жизни. Боль и страх перед серьезными заболеваниями являются основными причинами обращения за медицинской консультацией. Расходы, которые несет здравоохранение по обследованию и лечению пациентов с функциональной диспепсией, огромны в силу высокой распространенности и составляют, например, в Швеции 400 млн долларов на 10 милллионов населения.
Этиология и патогенез.
Вопросы этиологии и патогенеза синдрома функциональной диспепсии до сих пор остаются недостаточно изученными. Имеются доказательства нарушения моторики желудка и двенадцатиперстной кишки в патогенезе функциональной диспепсии. К нарушениям гастродуоденальной моторики, характерным для этого заболевания относят ослабление моторики антрального отдела желудка с последующим замедлением эвакуации из желудка (гастропарез), нарушения антродуоденальной координации, расстройства ритма перистальтики желудка (тахигастрия, брадигастрия), нарушения аккомодации желудка (т.е. способности проксимального отдела желудка расслабляться после приема пищи).
При нормальной эвакуаторной функции желудка причинами диспептических жалоб может быть повышенная чувствительность рецепторного аппарата стенки желудка к растяжению (так называемая висцеральная гиперчувствительность), связанная либо с истинным повышением чувствительности механорецепторов стенки желудка или же с повышенным тонусом его фундального отдела.
Роль инфекции Н. pylori при ФД является спорной. Накопленные в настоящее время данные не дают оснований считать H. pylori существенным этиологическим фактором возникновения диспептических расстройств у большинства больных с функциональной диспепсией. Проведение эрадикации может оказаться полезным лишь у части таких пациентов.
Имеются убедительные доказательства ассоциации диспепсии с психопатологическими факторами и сопутствующими психиатрическими расстройствами, особенно тревогой. В настоящее время роль этой ассоциации в развитии функциональной диспепсии изучается. Была обнаружена связь психосоциальных отклонений с эпигастральной болью и гиперсенситивностью к растяжению желудка при ФД.
Необследованная и обследованная диспепсия. Важно, особенно исходя из эпидемиологическим данных, разграничивать необследованную диспепсию от обследованной, когда после проведенных обследований может быть найдена (или не найдена) причина имеющейся симптоматики. Для популяции наших больных это положение Консенсуса имеет особое значение, учитывая значительную распространенность рака желудка в сравнении со странами Западной Европы и США. Фактически проведение фиброэзофагогастродуоденоскопии (ФЭГДС) обеспечивает перевод необследованный диспепсии в обследованную.
Органическая и функциональная диспепсия
В тех случаях, когда симптомы диспепсии бывают обусловлены такими заболеваниями, как язвенная болезнь, гастроэзофагеальная рефлюксная болезнь (с эзофагитом и без эзофагита), злокачественные опухоли, желчнокаменная болезнь и хронический панкреатит, или метаболическими причинами (побочное действие лекарств), принято говорить о синдроме органической диспепсии. В случае органической диспепсии, если заболевание излечивается, симптоматика уменьшается или исчезает.
Если при тщательном обследовании больного указанных заболеваний выявить не удается, правомерно ставить диагноз функциональной диспепсии.
Соотношение понятий “хронический гастрит” и “функциональная диспепсия”
Существует противоречие в подходах к трактовке больных с синдромом диспепсии среди российских и зарубежных клиницистов. Так, в нашей стране врачами при отсутствии заболеваний, включенных в группу органической диспепсии, больному с синдромом диспепсии будет выставлен диагноз “хронический гастрит”. За рубежом врач в аналогичной ситуации воспользуется диагнозом “функциональная диспепсия”. Термином “хронический гастрит” пользуются в основном морфологи. Многочисленные исследования, проведенные в последние годы, многократно доказали отсутствие какой-либо связи между гастритическим изменениями слизистой оболочки желудка и наличием у пациентов диспепсических жалоб.
Частота хронического гастрита в популяции оказывается очень высокой и достигает 80%. При этом, однако, в подавляющем большинстве случаев протекает он бессимптомно и многие больные чувствуют себя практически здоровыми.
“Клинический” диагноз гастрита, т.е. без морфологического исследования гастробиоптатов, практически не имеет смысла. В случае жалоб на боли и дискомфорт в эпигастральной области (при отсутствии изъязвления, по данным эндоскопического исследования) и для врача, и для пациента удобен синдромный диагноз функциональной диспепсии. Нередко выделяется и такой диагноз – “ хронический гастрит с функциональной диспепсией”, хотя подразумевается одно и то же (разумеется, при наличии морфологически подтвержденного гастрита).
Классификация.
В классификации функциональной диспепсии выделяют:
- постпрандиальный дистресс-синдром (ПДС) (диспепсические симптомы, вызываемые приемом пищи).
- Синдром эпигастральной боли (СЭБ).
Диагностика и дифференциальная диагностика
Комитет экспертов (Римские критерии IIΙ, 2006) предложил диагностические критерии функциональной диспепсии на двух уровня: собственно функциональной диспепсии (B1) и ее вариантов (Табл. 2).
Таблица 2. Диагностические критерии функциональной диспепсии
| B1. Диагностические критерии1 функциональной диспепсии |
| Должны включать:
1. Один или более из следующих симптомов: a. Беспокоящее (неприятное) чувство полноты после еды b. Быстрое насыщение c. Эпигастрапьная боль d. Жжение в эпигастральной области И 2. Отсутствие данных об органической патологии (включая ФЭГДС), которая могла бы объяснить возникновение симптомов 1Соответствие критериям должно соблюдаться в течение не менее 3-х последних месяцев с начала проявлений и не менее 6 месяцев перед диагностикой |
| B1a. Диагностические критерии2 постпрандиального дистресс-синдрома |
Должны включать один или оба из нижеследующих симптомов:
2Соответствие критериям должно соблюдаться в течение не менее 3-х последних месяцев с начала проявлений и не менее 6 меяцев перед диагностикой Подтверждающие критерии
|
| B1b. Диагностические критерии3 синдрома эпигастральной боли функциональные гастродуоденальные расстройства |
Должны включать все из нижеследующих:
3Соответствие критериям должно соблюдаться в течение не менее 3-х последних месяцев с начала проявлений и не менее 6 месяцев перед диагностикой Подтверждающие критерии
|
Таким образом, диагностика функциональной диспепсии предусматривает, прежде всего, исключение органических заболеваний, протекающих с аналогичными симптомами: гастроэзофагеальная рефлюксная болезнь, язвенная болезнь, рак желудка, желчно-каменная болезнь, хронический панкреатит. Кроме того, симптомокомплекс, свойственный диспепсии, может встречаться при эндокринных заболеваниях (например, диабетическом гастропарезе), системной склеродермии, беременности.
Для диагностики функциональной диспепсии применяются в обязательном порядке:
1. ФЭГДС с биопсией на Н.pylori
2. Клинические и биохимические анализы крови.
3. Анализ кала на скрытую кровь.
По показаниям проводятся:
- Ультразвуковое исследование органов брюшной полости (при клинических и биохимических данных, свидетельствующих о панкреатодуоденальной патологии).
- Рентгенологическое исследование желудка.
- Суточное мониторирование внутрипищеводного РН (для исключения ГЭРБ)
При проведении дифференциальной диагностики в случаях синдрома диспепсии важно своевременное выявление “симптомов тревоги” (alarm symptoms) или “ красных флагов” (red flags). Обнаружение у больного хотя бы одного из “симптомов тревоги” ставит под сомнение наличие у него функциональной диспепсии и требует проведения тщательного обследования с целью поиска серьезного органического заболевания.
Таблица 3
“Симптомы тревоги” при синдроме диспепсии
- -Дисфагия
- -Рвота с кровью, мелена, гематохезия (алая кровь в стуле)
- -Лихорадка
- -Немотивированное похудание
- -Симптомы диспепсии впервые возникли в возрасте старше 45 лет
- -Анемия
- -Лейкоцитоз
- -Повышение СОЭ
Сочетание (overlap-синдром) ФД с ГЭРБ и СРК. Изжога, рассматриваемая как ведущий симптом, ГЭРБ, как и диспепсия, чрезвычайно широко распространены и могут существовать одновременно. Римский II Консенсус исключил больных с преобладанием изжоги из группы диспепсий, но последние исследования показали, что изжога, как доминирующий симптом, не всегда позволяет выделить больных ГЭРБ. В целом, сочетание ГЭРБ с ФД (ПДС или ЭБС) наблюдается, вероятно, достаточно часто, что необходимо учитывать как в клинической практике, так и при проведении научных исследований. Комитет экспертов рекомендует при наличии частых и типичных рефлюксных симптомов осуществлять предварительную диагностику ГЭРБ. В клинической практике и при проведении клинических исследований для предварительной диагностики ГЭРБ наличие частой изжоги может быть подтверждено использованием простых опросников. Наличие изжоги не исключает диагноза ФД (ПДС или ЭБС), если диспепсия сохраняется, несмотря на адекватную кислотосупрессивную терапию. Наслоение симптомов диспепсии и СРК также встречается достаточно часто. Возможно одновременное присутствие СРК и ФД (ПДС или ЭБС).
При упорном характере диспепсических симптомов полезной может оказаться консультация психиатра для исключения депрессии и соматоформных расстройств.
Согласно международным рекомендациям неинвазивное определение инфекции Н. pylori и последующая эрадикация («test and treat») является экономически целесообразной стратегией и позволяет уменьшить количество ФЭГДС. Эта стратегия показана больным без симптомов тревоги. «Test and treat» стратегия рекомендуется, т. к. позволяет лечить большинство случаев язвенной болезни (peptic ulcer disease) и предотвращает развитие гастродуоденальных заболеваний в будущем, хотя многие больные ФД после эрадикации не отмечают улучшения. В таких случаях следующим шагом в лечении является назначение ИПП. Стратегия «test and treat» наиболее целесообразна в регионах с высокой распространенностью Н. pylori — зависимой язвенной болезнью. Как известно, в наших регионах (в России) инфицированность Н. pylori чрезвычайно высока (60-90 %), а при дуоденальных язвах, по нашим данным, близка к абсолютной. С этих позиций стратегия «test and treat» у нас оправдана. Однако следует учитывать высокую заболеваемость раком желудка, в несколько раз выше, чем в США и странах Западной Европы. К тому же на сегодняшний день неинвазивная диагностика хеликобактерной инфекции у нас почти отсутствует, а стоимость эндоскопии в несколько раз ниже, чем в вышеупомянутых странах. В то же время российскими авторами поддерживается точка зрения предварительного проведения эзофагогастродуоденоскопии для исключения органической патологии, а затем – лечения. Поэтому у нас в клинической практике при наличии диспептических жалоб целесообразно запланировать ФЭГДС.
Лечение
Лечение больных с синдромом функциональной диспепсии должно быть комплексным и включать в себя не только лекарственную терапию, но и мероприятия по нормализации образа жизни, режима и характера питания, при необходимости – психотерапевтические методы. В последнем 7-м издании, пожалуй, наиболее авторитетного в настоящее время руководства по гастроэнтерологии (Sleisenger & Fordtran ’s Gastrointestinal and Liver Disease, 1998), общие мероприятия, проводимые при лечении больных с функциональной диспепсией, сформулированы в виде рекомендаций для практических врачей.
Рекомендации при лечении больных с функциональной диспепсией (McQuaid, 1998)
- -Определите причину, заставившую больного обратиться за медицинской помощью. Тщательно выясните медицинский, семейный и социальный анамнез больного. Это позволит выявить стрессы, которые вызвали ухудшение самочувствия.
- -Выясните, не могли ли изменения рациона питания или прием каких-либо лекарственных препаратов вызвать появление у больного диспептических жалоб. Убедите пациента в необходимости отказа от курения, употребления кофе, приема алкоголя.
- -В беседе с больным характеризуйте функциональную диспепсию как реально существующее заболевание. Избегайте говорить пациенту, что причина имеющихся у него жалоб “ в его голове”.
- -Обсудите с пациентом патофизиологические механизмы имеющихся у него диспептических расстройств, включая изменения гастроинтестинальной моторики, повышенную висцеральную чувствительность, нарушенную нервную регуляцию двигательной функции желудочно-кишечного тракта.
- -При обдумывании плана лечения ставьте перед собой реальные цели. Имейте в виду, что большинство симптомов являются хроническими и характеризуются волнообразным рецидивирующим течением.
- -В случае рефрактерности диспептических симптомов не забывайте о возможности их психогенной природы и обращайтесь за помощью к психологу или психотерапевту.
Cоблюдение вышеуказанных рекомендаций действительно может оказаться полезным при лечении больных функциональной диспепсией. В необходимых случаях благоприятную роль в лечении таких больных может сыграть прием по согласованию с психотерапевтом – седативных препаратов и анксиолитиков. значение антидепрессантов в лечении ФД не установлено. В одном перекрестном исследовании амитриптилин в низких дозах уменьшал симптоматику, но не висцеральную гиперсенситивность или сон. У некоторых пациентов целесообразным является применение гипнотерапии и рациональной психотерапии. Существенное место должно отводиться подробной и обстоятельной беседе с больным. Слишком короткие рекомендации, сведение всей беседы к одной фразе (“У Вас ничего серьезного нет”) приводит к тому, что больной отправляется к другому врачу повторять весь комплекс уже ненужных исследований. Важно объяснить больному – конечно, с учетом его образовательного уровня – механизмы возникновения имеющихся у него диспептических расстройств с тем, чтобы показать возможные пути их коррекции.
Медикаментозная терапия строится с учетом имеющегося у больного клинического варианта ФД. Снижение кислотопродукции является надежной первой линией лечения при условии отсутствия инфекции Н. pylori. Если первая доза оказывается недостаточной, возможно ее ступенчатое повышение. На прием ИПП хороший эффект наблюдается у пациентов с синдромом эпигастральной боли, но не с симптомами, зависящими от приема пищи. Мета-анализ контролируемых рандомизированных исследований с ИПП при ФД выявил преимущество этой группы препаратов над плацебо при лечении. Установлена значительная эффективность антагонистов Н2-рецепторов в сравнении с плацебо. Н2-блокаторы гистаминовых рецепторов и ИПП применяются в стандартных дозах: фамотидин в дозе 20 мг 2 раза в сутки, омепразол 20 мг 2 раза в сутки. Эффективны новые блокаторы протонной помпы (лансопразол в дозе 30 мг в сутки, рабепразол в дозе 20 мг 1 раза в сутки, эзомепразол в дозе 20 мг в сутки).
Больные ФД нередко принимают антациды, хотя нет доказательств их эффективности.
По данным Кохрейновского мета-анализа установлено, что после эрадикации уменьшение объединенного относительного риска симптоматики ФД составляет 8 % в сравнении с плацебо при наблюдении в течение 12 месяцев. Учитывая, что эрадикация может вызвать устойчивую ремиссию у небольшой части больных, перед ее проведением следует обсудить с пациентом пользу и риск проведения такого лечения. У части пациентов (примерно у 20 – 25%) c CЭБ при наличии Н.р. эффективна эрадикационная антигеликобактерная терапия схемами первой и второй линий (тройная и квадротерапия). В соответствии с Маастрихтским соглашением -3 (2005 г) наиболее предпочтительной схемой первой линии в настоящее время является назначение в течение 14 дней тройной терапии в составе блокатора протонного насоса (в стандартной дозе дважды в день), кларитромицина (по 0,5 г 2 раза в день), амоксициллина (по 1,0 г 2 раза ) или метронидазола (по 500 мг 2 раза), если резистентность наиболее распространенных штаммов Н.р. в данном регионе к метронидазолу не превышает 40% и, альтернативной схемой первой линии в случае непереносимости препаратов, входящих в схему тройной терапии, является квадротерапия; схемой второй линии ─ квадротерапия ( блокаторы протонного насоса в тех же дозах, препараты висмута, например, коллоидный субцитрат висмута –де-нол по 120 мг 4 раза в день, тетрациклин по 0,5 4 раза в день и метронидазол по 0,25 мг 4 раза в день).
В лечении больных с ПДС основное место занимают прокинетики – препараты, нормализующие двигательную функцию желудочно-кишечного тракта. Препаратом выбора является мотилиум. Применение метоклопрамида (особенно длительное) признано в настоящее время нежелательным, т. к. этот препарат проникает через гематоэнцефалический барьер и вызывает у большого числа больных (20 – 30%) серьезные побочные эффекты.
Другие препараты, в частности, уменьшающую висцеральную гиперчувствительность (фетодоцин), лекарственные средства, обладающие спазмолитической активностью (тримебутин), препараты, оказывающие противотошнотное действие (ондансетрон), и препараты, релаксирующие дно желудка, новые прокинетики, селективные ингибиторы обратного захвата серотонина находятся в настоящее время на стадии клинического изучения.
3. Хронический гастрит
Хронический гастрит – хроническое воспаление слизистой оболочки желудка, сопровождающееся развитием различных специфических морфологических изменений, характерных для разных форм заболевания, и поэтому диагностируемое на основании морфологического исследования биоптатов слизистой оболочки желудка.
Классификация
Общепринята Сиднейская классификация гастрита (1990), модифицированная в Хьюстоне (1994). Она объединяет этиологический, топографический и морфологический принципы оценки заболевания.
I. По этиологии:
- 1) ассоциированный с Helicobacter pylori (тип В);
- 2) аутоиммунный (тип А),
- 3) химический или рефлюкс-гастрит или реактивный гастрит ( тип С);
- 4) идиопатический (с невыясненными этиологией и патогенезом);
- 5) особые формы гастритов (лимфоцитарный, гранулематозный, радиационный, и др.).
II. По топографии поражения:
- гастрит тела желудка,
- антрального, фундального и / или всех отделов желудка – пангастрит.
III. По морфологическим признакам оценивают наличие и степень воспаления, атрофии, метаплазии, обсемененности H.p. Гастриты делят на
- эрозивные
- неэрозивные.
ХГ может быть поверхностным и глубоким (трансмуральным).
Этиология и патогенез
Хронический хеликобактерный гастрит. Благодаря наличию множества факторов адгезии бактерии проникают через неактивный слой, покрывающий эпителий желудка, и плотно соединяются с клетками эпителия, вызывая их повреждение. В начальной фазе воспаления при инфицировании происходит активное размножение Н.р. Во второй фазе, на высоте воспаления, наряду с множеством бактерий резко выражена лейкоцитарная инфильтрация эпителия вплоть до формирования “ крипт-абсцессов”. В третьей фазе – разрешение воспаления – убывают степень обсеменения и выраженность лейкоцитарной инфильтрации. Нейтрофилы, цитотоксины бактерий и медиаторы воспаления оказывают выраженное повреждающее действие на поверхностный эпителий. Значительная плазмоцитарная инфильтрация слизистой и собственной пластинки рассматриваются как иммунная реакция на Н.р. Длительное инфицирование Н.р. слизистой оболочки желудка ведет к постоянному повреждению эпителия, его пролиферации и миграции. Преобладание процессов пролиферации над процессами дифференциации эпителия является основным фактором в патогенезе хронического геликобактерного гастрита. Установлена тесная связь между хроническим воспалением и иммунным ответом на бактерию Н.р. Титры анти-Н.р. IgG в сыворотке крови больных коррелируют с интенсивностью воспаления и числом лимфоидных фолликулов в слизистой оболочке желудка, которые сопровождают течение Н.р. гастрита, играют роль при развитии специфических лимфом, получивших название MALT-омы (mucosa-associated lymphoid tissue ly mphmas); по цитологическому строению они представляют собой низкодифференцирванные b-клеточные лимфоидные опухоли, которые инфильтрируют железистый эпителий.
Аутоиммунный метапластический атрофический гастрит А (АМАГ) – аутосомно-доминантное заболевание, при котором аутоиммунный ответ направлен против париетальных клеток желудка и внутреннего фактора Кастла, вырабатываемого слизистой оболочкой проксимального отдела желудка, что приводит к развитию дефицита витамина В12 и пернициозной анемии. Характерной особенностью гастрита А является локализация поражения в фундальном отделе и теле желудка, в то время, как антральный отдел остается интактным. В указанных отделах желудка развивается тяжелый атрофический гастрит с прогрессирующей потерей массы париетальных клеток, желез и замещением их псевдохлоргидрией, снижением уровня пепсиногена I, внутреннего фактора. В тяжелых случаях дефицит внутреннего фактора приводит к нарушению всасывания витамина В12 и развитию мегалобластной (пернициозной) анемии.
Риск развития карциномы желудка при пернициозной анемии, ассоциированной с АМАГ, в 3-18 раз выше, чем в общей популяции. АМАГ обычно редко сочетается с инфекцией Н.р
Реактивный или истинный рефлюкс-гастрит развивается практически у всех пациентов после резекции желудка, пилоропластики и частичной резекции желудка. Желчный или химический, рефлюкс-гастрит – хроническое состояние при котором постоянный заброс (рефлюкс) кишечного содержимого, включающего желчные кислоты, вызывает повреждение слизистой оболочки желудка и приводит к развитию дистрофических и некробиотических изменений эпителия культи желудка. Кроме того, аналогичные изменения слизистой оболочки наблюдаются при приеме нестероидных противовоспалительных препаратов (НПВП), при дуоденогастральном рефлюксе желчи, приеме алкоголя, препаратов железа и калия.
Эпидемиология. В настоящее время в популяции Х.Г. встречается в 80% случаев. Н.р.-ассоциированный гастрит является самым распространенным, занимая 85% в структуре различных типов гастритов, что определяется эпидемиологией инфекции Н.р. Данная инфекция относится к наиболее распространенной хронической инфекции человека и встречается у 80 – 90% жителей развивающихся стран Азии и Африки, у 40 – 70% жителей Восточной Европы, Южной Америки и у 25 – 30% населения развитых стран Европы и Северной Америки. Аутоиммунный метапластический атрофический гастрит встречается редко – у 1% лиц в общей популяции. Среди больных с макроцитарной гиперхромной анемией его диагностируют в 16% случаев. Эпидемиология реактивного гастрита имеет свои особенности, так как обусловлена частотой резекций желудка и применения НПВП, распространенностью алкогольной болезни.
Клиническая картина ХГ. Чаще всего ХГ протекает бессимптомно. Имеющаяся клиника при ХГ зависит от варианта функциональной лиспепсии. АМАГ протекает чаще всего бессимптомно до тех пор, пока не разовьется одно из его осложнений (дефицит витамина В12 или злокачественное поражение желудк). При аутоиммунном гастрите чаще, чем при других его формах, развивается гиперплазия G-клеток, которая может привести к развитию нейроэндокринных опухолей (карциноиду). При рефлюкс-гастрите на первый план могут выходить симптомы демпинг-синдрома и гипогликемии.
Особые формы гастрита
Эозинофильный (аллергический) гастрит. Наблюдается у больных с аллергическими заболеваниями, характеризуется выраженной инфильтрацией стенки желудка эозинофилами и имеет рецидивирующее течение, возможно повреждение эпителия вплоть до некроза. Часто в патологический процесс вовлекаются тонкая, ободочная кишка и пищевод с развитием эозинофильного гастроэнтерита. В периферической крови отмечается эозинофилия. Обнаруживаемые при этой форме гастроэнтерита изменения никогда не бывают патогномоничными. Аналогичные гистологические признаки могут быть при карциноме, лимфоме желудка, болезни Крона, васкулите или паразитарных болезнях. Для дифференциальной диагностики первичного и вторичного поражения желудка проводится биопсия его антрального отдела.
Гранулематозный гастрит. Идиопатический тип этого гастрита встречается редко. Эндоскопически может быть сходным с аденокарциномой. Чаще встречается гранулематозный гастрит специфических типов, который бывает при болезни Крона (около 50% больных), туберкулезе и других инфекциях, инородных телах в желудке.
Лимфоцитарный гастрит (вариолоформный, хронический эрозивный гастрит). Одним из характерных признаков является интенсивная лимфоцитарная инфильтрация поверхностного и ямочного эпителия, сопровождающаяся его повреждением. Диагноз устанавливают при обнаружении более 25 лимфоцитов на 100 эпителиальных клеток ( в норме их число не превышает 4 – 7 на 100 клеток). заболевание характеризуется больших утолщенных складок, которые отличаются от таковых при болезни Менетрие тем, что пересекают привратник. Вариолоформный гастрит обнаруживают как случайную находку при виде множества эрозий и узелков с изъязвленной поверхностью на вершинах утолщенных складок. В 80% случаев определяется пангастрит. Заболевание протекает либо изолированно, либо в сочетании с инфекцией Н.р., целиакией, лимфоцитарным и коллагенозным колитом.
Радиационный гастрит. Применение лучевой терапии может привести к умеренным или тяжелым коагуляционным некрозам слизистой оболочки желудка с вторичной воспалительной инфильтрацией. Умеренные изменения, как правило обратимы и регрессируют с восстановлением слизистой до нормы на протяжении 4 мес. Тяжелое радиационное поражение сопровождается образованием язв, фиброзом и облитерирующим гиалинозом сосудов.
Болезнь Менетрие – заболевание, вызываемое неизвестной причиной, клинически проявляющееся анорексией, тошнотой, рвотой, гастроинтестинальными кровотечениями, диареей, потерей массы тела до 25 кг, болями в эпигастральной области, гипохлоргидрией и потерей белка вплоть до развития гипоальбуминемических (безбелковых) отеков. Болезнь Менетрие поражает взрослых в возрасте от 30 до 60 лет, носит хронический характер. Уровень базальной и стимулированной секреции низкий или нормальный, уровень гастрина может слегка повышенным. Трансформирующий фактор роста “альфа” значительно повышается в клетках желудочного эпителия и может играть важную патогенетическую роль в развитии заболевания. Сведения о высоком риске развития рака желудка противоречивы (есть данные, что карцинома желудка встречается в 10% случаев). Эндоскопическая картина характеризуется гигантскими складками слизистой оболочки тела и дна желудка, которые никогда не пересекают привратник. На слизистой оболочке видны полиповидные разрастания, благодаря которым желудок приобретает вид “ булыжной мостовой”. Гистологически характеризуется гиперплазией фовеолярного эпителия, невыраженными признаками воспаления, образованием кист, потерей париетальных клеток, развитием кишечной метаплазии, в связи, с чем биопсия обязательна для исключения дисплазии и/или карциномы. Сепсис, сосудистые и тромбоэмболические осложнения представляют большую угрозу больным
Связь хронического гастрита и рака желудка. К предраковым изменениям слизистой оболочки желудка (изменения, непосредственно, переходящие в рак) относят нарушения пролиферации (болезнь Менетрие, аденоматозы), атрофические изменения слизистой оболочки (чаще всего хронический атрофический гастрит), дисплазию эпителия (II-III стадии).
Среди предраковых заболеваний первое место занимает хронический атрофический гастрит. Значение в его развитии имеет H. pylori, который вызывает локальный иммунный ответ. Активно влияя на процессы, происходящие в генеративной зоне желудочных желез, H.pylori приводит при ассоциированном с этими микроорганизмами гастрите к расширению зоны компартмента и его суперспециализации, причем доля клеток, находящихся в фазе синтеза ДНК, увеличивается более чем в 2 раза, что влечет за собой появление функционального быстро погибающего эпителия. Вследствие этого развивается хронический атрофический гастрит, появляются мутантные клетки, нарушается функция гена р453, который предотвращает накопление и фиксацию генетических повреждений в клонах пролиферирующих клеток, т.е. угнетает апоптоз.
Диагностика
Эндоскопическая диагностика относится к основным методам диагностики ХГ. Позволяет выявить: форму ХГ (поверхностный, атрофический, гипертрофический); распространенность процесса, стадию заболевания (обострение, ремиссия). Предварительное введение некоторых красителей (1% метиленовая синь), различно окрашивающих нормальную и измененную слизистую оболочку желудка, повышает точность эндоскопической диагностики (хромоскопия). Гастроскопия важна при проведении дифференциальной диагностики хронического гастрита от язвенной болезни, злокачественных новообразований желудка.
Морфологическое исследование гастробиоптатов имеет решающее значение в диагностике различных форм ХГ. Наиболее точная картина может быть получена при изучении не менее 5 биоптатов: по 2 из антрального и фундального отделов и одного из области угла желудка.
Для унификации гистологических заключений предложена визуально-аналоговая шкала, применение которой значительно снижает субъективность оценки морфологических изменений (степень обсеменения Н.р., нейтрофильной и мононуклеарной инфильтрации, стадии атрофии и кишечной метаплазии).
Рентгенологическая диагностика. Метод не позволяет выявить основные формы ХГ, но с его помощью возможна диагностика особых форм ХГ (полипозного, гипертрофического, в т.ч. болезни Менетрие, антрального ригидного), исключение язвы, полипов, рака и других заболеваний желудка, выявление нарушений тонуса и моторно- эвакуаторной функции желудка.
Лабораторная диагностика.
- Общий анализ крови в норме, у больных с АМАГ и диффузной формой хронического гастрита, ассоциированного с Н.р. (в случаях резкой атрофии слизистой оболочки тела желудка) могут быть признаки В12-дефицитной анемии.
- У больных с АМАГ определяется высокий уровень гастрина в крови (норма до 100 нг/л ).
- Иммунологический анализ крови: определяются антитела к обкладочным клеткам и внутреннему фактору Кастла при АМАГ и к Н.р. при ХГ, ассоциированном с Н.р.
- Метод интрагастральной рН-метрии: абсолютным критерием выраженности АМАГ считается отсутствие снижения внутрижелудочного рН ниже 6,0 после субмаксимальной стимуляции гистамином. Уменьшение рН до 2,0 после стимуляции свидетельствует о наличии умеренно выраженного АМАГ.
- Определение Н.р. другими методами (морфологический, цитологический, уреазный, бактериологический, дыхательный, определение Н.р. в кале).
Пример формулировки диагноза:
Функциональная диспепсия, синдром эпигастральной боли.
Хронический неатрофический гастрит с высокой степенью обсемененности Helicobacter pylori (3+), умеренно выраженной нейтрофильной и мононуклеарной инфильтрацией.
Лечение
Лечение диспептических расстройств у больных ХГ должно быть комплексным, включающим в себя нормализацию образа жизни, диетические рекомендации, прием лекарственных препаратов. Медикаментозная терапия строится с учетом имеющегося у больного клинического варианта функциональной диспепсии (см. выше). Проведение эрадикационного антигеликобактерного лечения (по одной из схем тройной терапии или квадротерапии) показано больным НР-ассоциированным хроническим атрофическим гастритом, хроническим эрозивным гастритом, НР-ассоциированным хроническим гастритом (дуоденитом) при наличии наследственной предрасположенности к раку желудка, необходимости приема нестероидных противовоспалительных препаратов (проводится до назначения нестероидных противовоспалительных препаратов), перед длительным курсом ингибиторов протоновой помпы при ГЭРБ.
В случае развития В12 ─ дефицитной анемии ─ парентеральное введение оксикобаламина или цианокобаламина.
Литература
- Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. М.: Триада-Х, 1998; 483.
- Васильев Ю.В. Хронический гастрит. Соnsilium medicum: Приложение, 2002; 3: 6 – 10.
- Маев И.В., Самсонов А.А. Современные стандарты лечения кислото-зависимых заболеваний, ассоциированных с H.pylori (материалы консенсуса Маастрихт-3). Соnsilium medicum: Приложение, 2006; 1: 3 – 8.
- Минушкин О.Н. Функциональная диспепсия. Соnsilium medicum: Приложение, 2006; 1: 8 – 12.
- Carlsson R., Dent J., Вoiling-Sternevald E. et al. The usefulness of a structured questionnaire in the assessment of symptomatic gastroesophageal reflux disease. Scand J Gastroenterol. 1998; 33:1023–1029.
- Drossman D.A. The functional gastrointestinal disorders and the Rome ΙΙΙ process. Gastroenterolology. 2006; 130(5): 1459–65.
- McQuaid K. Dispepsia. In: M. Feldman et al. (Eds.) Sleisenger and Fordtan’s gastrointestinal and liver disease, (6-th ed.) Philadelphia-London-Toronto-Montreal-Sydney-Tokyo, 1998; 105–117.
- Moayyedi P., Soo S., Decks J. et al. Pharmacological interventions for non-ulcer dyspepsia. Cochrane upper gastrointestinal and pancreatic diseases group. Cochrane Database Syst. Rev. 2003; (3):CD001960.
- Peura DA., Kovacs TO., Metz DC. et al. Lansoprazole in the treatment of functional dyspepsia: two double-blind, randomized, placebo-controlled trials. Am. J. Med. 2004; 116: 740–8.
- Tack J., Caenepeel P., Arts. J. et al. Lee KJ, Sifrim D, Janssens J. Prevalence and symptomatic impact of non-erosive reflux disease in functional dyspepsia. Gut. 2005; 54:1370–6.
- Talley N.J., Meineche-Schmidt V., Pare P. et al. Efficiency of omeprazole in functional dyspepsia: double-blind, randomized, placebo-controlled trials (the Bond and opera Studies). Aliment. Pharmacol. Ther. 1998; 12: 1055–65.