Неревматические миокардиты
Содержание страницы
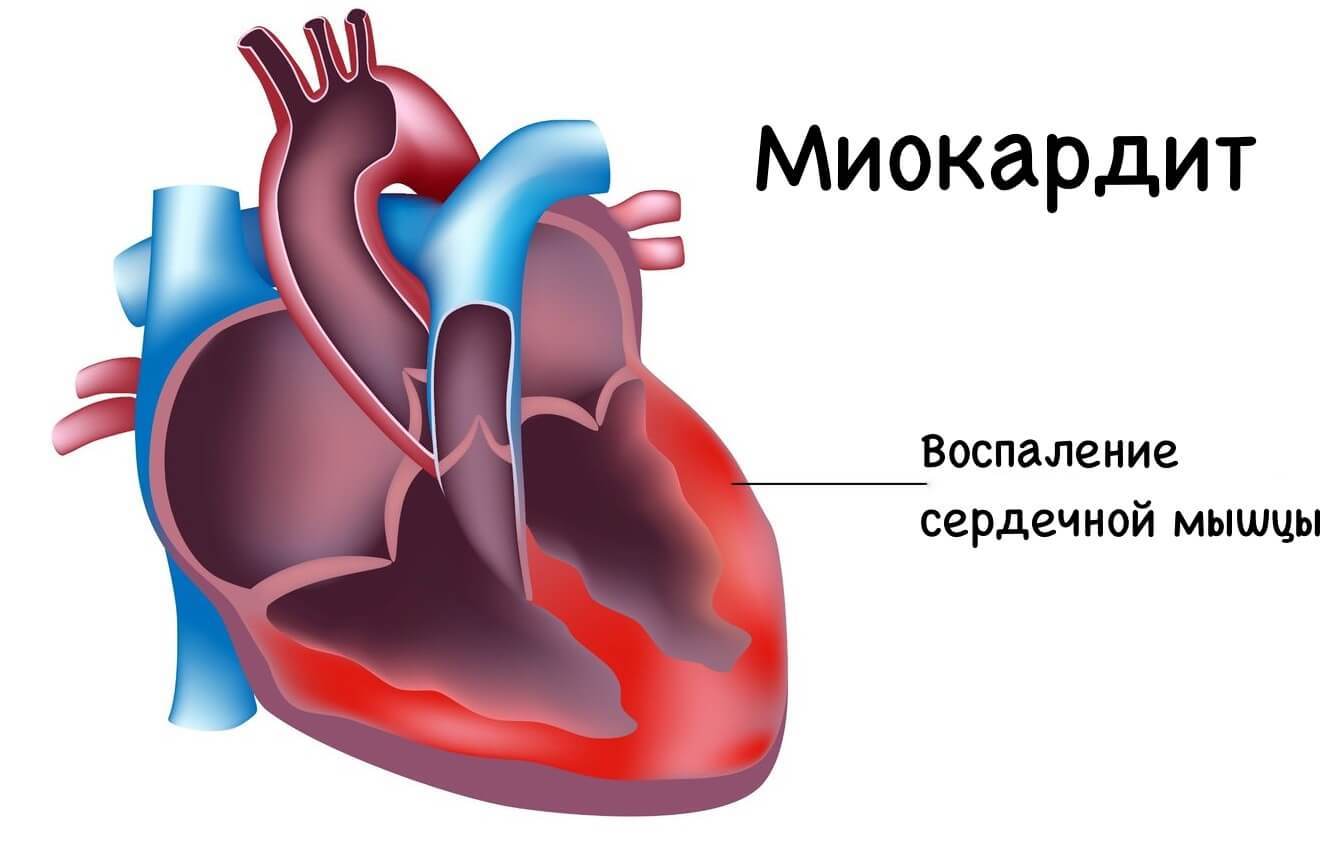
Миокардиты, составляющие большую группу некоронарогенных заболеваний миокарда, представляют собой поражения сердечной мышцы преимущественно воспалительного характера, связанные с непосредственным влиянием инфекции, паразитарными и протозойными инвазиями, химическими и физическими воздействиями, а также возникающие на почве аллергических и аутоиммунных заболеваний. Доказано, что наибольшей кардиотропностью обладают вирусы, а вирусная этиология считается наиболее аргументированной. В качестве доказательств вирусной теории развития миокардитов приводят следующие факты:
- высокая заболеваемость миокардитами в период вирусных эпидемий;
- обнаружение вирусов в носоглотке и испражнениях больных в течение первой недели острого миокардита, выявление в крови титра вирусных антител, начиная со 2–3 недели развития острого миокардита;
- выделение из миокарда вирусов и вирусной ДНК и РНК методом полимеразной цепной реакции;
- отработана экспериментальная модель миокардита, где заболевание развивается при заражении лабораторных животных различными вирусами, преимущественно энтеровирусами.
К неинфекционным факторам, приводящим к возникновению миокардитов, относят некоторые лекарственные препараты-антибиотики и сульфаниламиды, лечебные сыворотки, вакцины, термические и радиохимические воздействия.
В зависимости от патогенетических механизмов развития болезни выделяют миокардиты:
- инфекционные;
- инфекционно-аллергические (иммунологические);
- токсико-аллергические;
По распространенности поражения сердечной мышцы миокардиты подразделяются на:
- очаговые;
- диффузные.
Патогенетические механизмы развития миокардитов:
- Прямой цитотоксический эффект причинного фактора. Ряд микроорганизмов способен внедряться в кардиомиоцит. Это в наибольшей мере относится к вирусу Коксаки В. Проникновение вируса Коксаки В в кардиомиоцит происходит после его взаимодействия с рецепторами, расположенными на поверхности кардиомиоцита. Затем вирус реплицируется в цитоплазме и может далее внедряться в непораженные кардиомиоциты. Под влиянием инфекции стимулируется продукция лимфоцитами и фибробластами интерферонов α и β, которые увеличивают устойчивость к вирусной инфекции непораженных кардиомиоцитов и стимулируют активность макрофагов и натуральных киллеров. В кардиомиоцит способны проникать также вирусы гриппа и гепатита С, токсоплазмы. Бактериальная флора также способна внедряться в кардиомиоциты. Наиболее часто в миокарде обнаруживаются стафилококки при септических состояниях. Внедрение инфекционного агента в кардиомиоцит вызывает его повреждение, деструкцию лизосомальных мембран и выход из них кислых гидролаз, усугубляющих повреждение миокарда. Указанные процессы создают также предпосылки для образования в миокарде аутоантигенов и формирования аутоиммунных реакций. Выделяемые инфекционными агентами токсины способны непосредственно воздействовать на миокард, вызывая в нем значительные дистрофические изменения. Нарушаются процессы метаболизма, повреждаются органеллы кардиомиоцита. Токсины поддерживают течение воспалительного процесса. Кроме того, продуцируемые инфекционными агентами токсины способствуют развитию токсико-аллергического процесса в миокарде в связи с образованием к ним антител.
- Вторичный иммунный ответ, который может быть запущен с помощью причинного фактора. Поврежденный миокард становится источником аутоантигенов, которые индуцируют образование аутоантител против миолеммы, сарколеммы, но чаще всего против α и β-цепей миозина. Существует мнение, что при миокардите антитела вырабатываются не только к поврежденным, но и к неповрежденным кардиомиоцитам, при этом высвобождаются новые антигены, стимулирующие образование антител к компонентам кардиомиоцитов.
- Экспрессия цитокинов в миокард (например, фактор некроза опухолейальфа, нитрикоксидсинтаза). Большую роль в развитии миокардита играет нарушение цитокинового баланса. Обнаружена корреляция между повышением уровня цитокинов в крови и воспалительными изменениями в миокарде. Цитокины — это низкомолекулярные гликопротеины и пептиды, секретируемые активированными клетками иммунной системы, иногда эпителием, фибробластами, осуществляющие регуляцию взаимодействий и активацию всех звеньев системы иммунитета и влияющие на различные органы и ткани. У больных миокардитом значительно повышается уровень в крови провоспалительных цитокинов — интерлейкина-1, интерлейкина-6, фактора некроза опухоли-α, которые поддерживают воспалительный процесс в миокарде. Одновременно в плазме крови больных миокардитом существенно возрастает уровень интерлейкина- 2 и содержание интерферона-γ.
- Аберрантная индукция апоптоза. Апоптоз — запрограммированная клеточная смерть. Процесс, благодаря которому из многоклеточного организма удаляются поврежденные, завершившие свой жизненный путь или нежелательные клетки. Апоптоз протекает без повреждения клеточного микроокружения. Кардиомиоциты являются высоко- и окончательно дифференцированными клетками, и в норме апоптоза кардиомиоцитов не наблюдается. При миокардитах развивается апоптоз. Апоптоз при миокардите может индуцироваться цитотоксическими Т-лимфоцитами, фактором некроза опухоли-α, свободными радикалами, токсинами, вирусами, избыточным накоплением ионов кальция в кардиомиоцитах. Окончательно роль апоптоза кардиомиоцитов при миокардите не уточнена. Предполагается, что он наиболее выражен при наиболее тяжелых формах заболевания, сопровождающихся нарушением кровообращения, и при дилатационной кардиомиопатии.
Фазы патогенеза миокардита:
- Острая фаза (первые 4–5 дней). Характеризуется тем, что внедрившийся в кардиомиоциты патогенный агент вызывает лизис сердечных клеток и одновременно реплицируется в них. В этой фазе активируются и экспрессируют, макрофаги, выделяя ряд цитокинов (интерлейкин-1 и 2, фактор некроза опухоли, интерферон-γ). В этой же фазе наблюдается виремия и вирусы обнаруживаются в биоптатах миокарда. Происходит деструкция миоцитов, которая затем повторно вызывает повреждение и дисфункцию миокарда.
- Подострая фаза (с 5–6 го дня). Наблюдается воспалительная инфильтрация миокарда мононуклеарными клетками: натуральными киллерами, цитотоксическими Т-лимфоцитами и В-лимфоцитами. Возникает вторичный иммунный ответ. Цитотоксические Т-лимфоциты также участвуют в лизисе кардиомиоцитов, содержащих вирусы. В-лимфоциты вырабатывают антитела к вирусам и компонентам кардиомиоцитов. С 5 дня патологического процесса начинается синтез коллагена, достигая максимума после 14 дня. После 14 дней вирус в миокарде уже не обнаруживается, постепенно стихает воспаление.
- Хроническая фаза (после 14–15 дня). Начинает активно прогрессировать фиброз, развивается дилатация миокарда, постепенно в последующем формируется дилатационная кардиомиопатия, развивается недостаточность кровообращения. Виремии нет. Продолжается деструкция миоцитов аутоиммунной природы, ассоциированная с патологическим выделением антигена человеческих лейкоцитов (HLA) в миоциты. В случае вирусного миокардита возможна персистенция вирусного генома в миокарде.
По течению и длительности процесса миокардиты подразделяются на:
- острые;
- подострые;
- рецидивирующие; хронические;
- латентные.
Клиническая картина миокардита
Ведущим клиническим признаком, определяющим тяжесть течения миокардита, может быть: сердечная (острая или хроническая) недостаточность, нарушения ритма и проводимости, тромбоэмболии.
Как правило, в анамнезе имеются указания на то, что за 1–2 недели до появления кардиальных жалоб были признаки инфекционного заболевания (повышение температуры тела, чихание, кашель с отделением слизистой мокроты, насморк, ощущение «ломоты» в костях, боли в мышцах, общая слабость, «першение» в горле, боли при глотании, иногда боли в животе, диарея). Но, в отличие от ревматического миокардита, светлого промежутка без клиники не наблюдается. Если миокардит обусловлен не вирусной инфекцией, а другими причинами, то в анамнезе могут быть соответствующие указания (например, перенесенная бактериальная инфекция, выраженная аллергическая реакция на лекарственные средства, наличие у пациента системного заболевания соединительной ткани или других какихлибо причин). Вирусным миокардитом чаще болеют лица молодого возраста и до 35–45 лет, хотя, конечно, заболевание может встречаться и в старшем возрасте. Субъективная и объективная симптоматика острого миокардита определяется степенью тяжести заболевания, очаговым или диффузным характером воспалительного процесса в миокарде.
Легкая форма заболевания проявляется маловыраженной клинической симптоматикой, иногда распознается только с помощью лабораторных и инструментальных методов исследования. На ЭКГ обнаруживаются нарушения фазы реполяризации, удлинение интервала PQ, иногда экстрасистолия. Таким образом, легкая степень тяжести миокардита характеризуется нормальными границами сердца, отсутствием недостаточности кровообращения, малой выраженностью клинических и лабораторных признаков, благоприятным прогнозом.
При средней степени тяжести миокардита в миокарде обычно обнаруживаются множественные очаги поражения, имеются четкие субъективные и объективные проявления заболевания, описанные выше. Характерно расширение левой границы относительной тупости сердца, однако нет недостаточности кровообращения. Лабораторные сдвиги достаточно выражены: обычно имеются положительные острофазовые реакции (увеличение СОЭ, α2— и γ — глобулинов, серомукоида, сиаловых кислот в крови). На ЭКГ обнаруживаются выраженные и долго сохраняющиеся изменения. Таким образом, главными отличительными признаками миокардита средней степени тяжести являются кардиомегалия, отсутствие застойной сердечной недостаточности, выраженность клинической и лабораторной симптоматики миокардита.
В основе развития тяжелой формы миокардита лежит диффузный воспалительный процесс в миокарде. При тяжелом течении миокардита общее состояние больных тяжелое, развивается острая левожелудочковая или тотальная сердечная недостаточность, кардиогенный шок. Границы сердца значительно расширены, выслушивается ритм галопа, практически всегда имеются нарушения сердечного ритма и проводимости, тромбоэмболические осложнения, резко изменены лабораторные показатели и данные ЭКГ.
Клинические варианты миокардита:
- Малосимптомный вариант. Характеризуется минимальными клиническими проявлениями, в частности, кардиалгический симптом выражен слабо, нет выраженных гемодинамических нарушений, изменения ЭКГ нестойкие, преходящие.
- Псевдокоронарный вариант. Отличается интенсивными болями в области сердца (иногда выраженность болей напоминает ангинозный статус); изменениями ЭКГ, напоминающими инфаркт миокарда или ишемические очаговые изменения; могут наблюдаться явления левожелудочковой недостаточности разной степени выраженности (от умеренных застойных явлений в легких до приступов сердечной астмы).
- Псевдоклапанный вариант. Характеризуется звуковой симптоматикой со стороны сердца, очень напоминающей звуковую картину порока сердца, чаще митральной недостаточности (прослушивается интенсивный систолический шум в области верхушки сердца) или сочетанного митрального порока сердца (интенсивный систолический шум, мерцательная аритмия), при этом возможны полиартралгия, недостаточность кровообращения. Для исключения порока сердца необходимо тщательное ультразвуковое исследование сердца, требуется также дифференцировать этот вариант заболевания с ревматизмом.
- Аритмический вариант. В клинической картине доминируют различные нарушения сердечного ритма, в то же время кардиалгия, недостаточность кровообращения выражены незначительно или даже отсутствуют.
- Тромбоэмболический вариант. Начинается с тромбоэмболических осложнений, чаще с тромбоэмболии легочной артерии, реже — с тромбоэмболии в артерии большого круга кровообращения, как правило, у больных отмечаются кардиомегалия и выраженная клиническая симптоматика застойной сердечной недостаточности кровообращения.
- Декомпенсированный вариант. Характеризуется тяжелой, тотальной, резистентной к лечению сердечной недостаточностью, кардиомегалией, относительной митральной и трикуспидальной недостаточностью, тяжелыми, часто комбинированными нарушениями сердечного ритма.
- Смешанный вариант. Самый частый вариант, характеризующийся сочетанием симптомов различных вариантов, то есть, по сути, развернутой клинической картиной миокардита.
Лабораторные данные
Общий анализ крови. У больных с легкой формой миокардита общий анализ крови существенно не изменяется. При миокардите средней степени тяжести и тяжелом отмечаются увеличение СОЭ, умеренное увеличение количества лейкоцитов с нейтрофильным и палочкоядерным сдвигом, моноцитозом. Наиболее выраженный лейкоцитоз и токсическая зернистость нейтрофилов характерны для бактериальных миокардитов. Вирусные миокардиты далеко не всегда сопровождаются лейкоцитозом, даже при выраженной клинической симптоматике.
Общий анализ мочи без изменений, однако при развитии выраженной сердечной недостаточности в моче обнаруживаются белок, цилиндры (преимущественно гиалиновые).
Биохимический анализ крови. Известно, что при повреждении кардиомиоцитов любой этиологии (ишемической, воспалительной или токсической) отмечается повышение концентрации кардиоспецифических ферментов и белков — креатинфосфокиназы (КФК), ее сердечного изоэнзима (КФК-МВ), лактатдегидрогеназы (ЛДГ), тропонина Т и тропонина I. Однако при воспалительном поражении миокарда эти маркеры далеко не всегда выходят за пределы нормальных значений; так по данным литературы, концентрация кардиоселективных ферментов и белков повышается только у 15–30 % больных. При этом надо иметь в виду, что данные биохимические маркеры отражают повреждение кардиомиоцитов с различной степенью специфичности. Концентрация ЛДГ (преимущественно ЛДГ-1) в крови отражает интенсивность анаэробного гликолиза и наличие лактатацидоза в миокарде. Креатинфосфокиназа принимает участие в транспорте АТФ от внутренней мембраны митохондрий к наружней и дальнейшему переносу к миофибриллам. Повышение концентрации КФК может происходить при повреждении любых миоцитов, в том числе и поперечнополосатой мускулатуры. Однако возрастание КФК-МВ является следствием разрушения только кардиомиоцитов. Кардиоселективные белки тропонин Т и тропонин I также появляются в крови только при повреждении кардиомиоцитов вследствие многих причин. Степень повреждения и разрушения кардиомиоцитов при миокардитах имеет не столь массивный характер, как, например, при инфарктах, поэтому концентрация кардиоселективных ферментов, как правило, повышается только в 1,5–2 раза. При миокардитах с выраженной клинической симптоматикой характерно наличие «биохимического синдрома воспаления»: увеличение содержания в крови фибрина, гаптоглобина, серомукоида, а2— и γ-глобулинов при снижении уровня альбуминов, появление, С-реактивного белка. Биохимический синдром воспаления наиболее выражен при декомпенсированном варианте миокардита.
Иммунологический анализ крови. При тяжелом течении миокардита может определяться дисбаланс в содержании в крови В- и Т-лимфоцитов, однако определению абсолютного их уровня в крови в настоящее время придается малое значение. В крови могут быть обнаружены циркулирующие иммунные комплексы. Для миокардитов, развивающихся на фоне или вскоре после перенесенной вирусной инфекции, характерно увеличение титра противовирусных антител в крови, обнаружение РНК вируса в крови с помощью полимеразной цепной реакции, а у 20–30 % больных миокардитами любого генеза в сыворотке крови выявляются антимиокардиальные антитела, а также антитела к миозину, актину, миолемме.
Инструментальные исследования
Рентгенологическое исследование грудной клетки. Рентгенологическая картина варьирует от кардиомегалии, венозного застоя в малом круге кровообращения до незначительного увеличения левого желудочка.
Электрокардиография. Изменения электрокардиограммы при миокардите не являются специфичными. Однако при легком течении миокардита изменения электрокардиограммы могут оказаться единственным признаком, свидетельствующим о поражении миокарда. Самыми частыми изменениями ЭКГ при миокардите являются изменения конечной части желудочкового комплекса. Эволюция наиболее частых изменений ЭКГ при миокардитах обычно проходит 3 последовательные стадии: 1 стадия острая (первые дни заболевания) — снижение интервала ST с одновременным уменьшением амплитуды или уплощением зубца Т; 2 стадия (2–3 неделя заболевания) — появление отрицательных, часто симметричных, заостренных зубцов Т; 3 стадия — нормализация ЭКГ. При нетяжелом течении длительность указанных изменений 6-8 недель. Из других изменений электрокардиограммы следует отметить сглаженность и деформацию зубца Р, снижение вольтажа QRS, удлинение интервала QT, что предрасполагает к эпизодам пароксизмальной желудочковой тахикардии. Для миокардита чрезвычайно характерны нарушения сердечного ритма и проводимости. У больных обычно регистрируется синусовая тахикардия, а при развитии синдрома слабости синусового узла (обычно при тяжелом миокардите) — брадикардия. Часто отмечается экстрасистолическая аритмия, возможны эпизоды суправентрикулярной или желудочковой пароксизмальной тахикардии, при тяжелом миокардите может быть мерцательная аритмия. Многие исследователи отмечают, что характерным признаком воспалительного процесса в миокарде является миграция водителя ритма. Нарушения проводимости — также характерный признак миокардита, могут наблюдаться внутрипредсердная, атриовентрикулярная (различной степени) и внутрижелудочковая блокады. Транзиторные нарушения проводимости и пароксизмальные расстройства ритма могут быть единственным проявлением активного воспалительного процесса в миокарде, и для более эффективного выявления и уточнения характера аритмии сердца приходится использовать суточное мониторирование ЭКГ по Холтеру.
Магнитно-резонансная томография (MPT). MPT миокарда с контрастированием также используется для диагностики миокардита. Парамагнитные контрасты (омнискан, галодиамид) накапливаются во внеклеточной жидкости, вызывают изменение активности MV-сигнала, показывая зону воспалительного отека. После обработки серии изображений миокарда до и после контрастирования можно сделать заключение о наличии миокардита. Чувствительность метода — 70–75 %.
Эхокардиография. Легкое течение миокардита обычно не сопровождается заметными эхокардиографическими изменениями.
При миокардите средней степени тяжести и тяжелой форме заболевания могут обнаруживаться следующие эхокардиографические признаки:
- дилатация полостей сердца, особенно левого желудочка; наличие зон гипо- и акинезии миокарда;
- уменьшение фракции выброса и снижение скорости циркулярного сокращения миокарда при развитии сердечной недостаточности; при этом возможно увеличение конечно-диастолического и конечно-систолического объемов левого желудочка;
- пролабирование створок митрального клапана (при дисфункции папиллярных мышц), митральная и (или) трикуспидальная регургитация (преимущественно при дилатации полостей сердца); наличие внутрисердечных тромбов (особенно при дилатации полостей сердца, мерцательной аритмии, развитии сердечной недостаточности);
- утолщение листков перикарда (более 4 мм, при норме не более 2,5 мм); наличие выпота в полости перикарда (указанные признаки появляются при миоперикардите). При наличии выпота происходит расхождение листков перикарда (расхождение листков на 3 мм соответствует примерно 100 мл жидкости). Радиоизотопные методы исследования. В диагностике миокардита определенное значение имеет радиоизотопное сканирование миокарда с 67Ga, который обладает аффинностью к нейтрофильным лейкоцитам, моноцитам, активированным Т-лимфоцитам, моноцитам. Эти клетки содержатся в воспалительных инфильтратах миокарда и 67Ga накапливается в них, визуализируя, таким образом, воспаленные участки миокарда. Диагностическое значение радиоизотопного сканирования миокарда с 67Ga значительно большее при остром миокардите или выраженном обострении. При подостром и хроническом вариантах течения миокардита диагностическое значение этого метода меньшее.
В последние годы для визуализации очагов воспаления в миокарде стали применять сцинтиграфию миокарда с помощью аутолейкоцитов, меченных 99Th.
Для выявления воспалительных очагов в миокарде предложен также метод радиоизотопного сканирования миокарда с применением антимиозиновых антител, меченных 111In. Чувствительность этого метода составляет 83 %, специфичность — 53 %.
Субэндомиокардиальная биопсия миокарда. Принято считать, что субэндокардиальная биопсия миокарда является наиболее точным методом диагностики миокардита, многие исследователи называют ее «золотым стандартом» диагностики этого заболевания.
В 1986 г. были согласованы рекомендации по гистологической диагностике миокардита, получившие название «Даласские критерии» (таблица 1).
Таблица 1 — Даласские критерии миокардита
| Определенный миокардит | Воспалительная инфильтрация миокарда с некрозом или дегенерацией прилегающих кардиомиоцитов, не характерная для ишемических повреждениях при ИБС. |
| Вероятный миокардит | Воспалительные инфильтраты достаточно редки либо кардиомиоциты инфильтрированы лейкоцитами. Нет участков кардиомиоцитонекроза. Миокардит не может быть диагностирован в отсутствии воспаления. |
| Отсутствие миокардита | Нормальный миокард или патологические изменения биоптата невоспалительной природы |
Первичная биопсия. Возможны следующие результаты:
- Миокардит: миокардиальный некроз, дегенерация, или и то и другое, при отсутствии выраженных признаков заболеваний коронарных артерий с прилегающими воспалительными инфильтратами, при наличии или отсутствии фиброза.
- Пограничный миокардит: воспалительный инфильтрат слишком разбросанный или повреждение миоцитов не наблюдается.
- Отсутствие миокардита.
Диагностика миокардита может оказаться весьма затруднительной в связи с неспецифичностью его симптоматики. Наиболее рациональным и доступным является подход к диагностике миокардита, базирующийся на критериях Нью-Йоркской ассоциации кардиологов.
Критерии диагностики миокардитов Нью-Йоркской ассоциации кардиологов (1973)
Предшествующая инфекция, доказанная клиническими и лабораторными данными (включая выделение возбудителя, результаты реакции нейтрализации, РСК, РПГА, увеличение СОЭ, появление СРП), или другое основное заболевание (лекарственная аллергия и др.), таблица 2.
Таблица 2 — Критерии диагностики миокардитов (1973 г.)
| Признаки поражения миокарда | |
| большие | малые |
| Патологические изменения ЭКГ (нарушение ритма, изменения интервала ST и др.) Повышение активности саркоплазматических энзимов и изоэнзимов в сыворотке крови (АсАТ, ЛДГ, КФК, ЛДГ). Кардиомегалия, по данным рентгеновского и ЭхоКГ. Застойная сердечная недостаточность или кардиогенный шок | Тахикардия
Ослабленный 1 тон Ритм галопа |
Для диагноза миокардита достаточно сочетания предшествующей инфекции или другого заболевания, согласно этиологии, с любыми двумя «малыми» и одним «большим» или с любыми двумя «большими» признаками. Позднее один из больших критериев «кардиогенный шок» было предложено заменить на «изменение иммунологических показателей».
Дифференциальный диагноз
Дифференциальный диагноз проводят с различными формами патологии сердца в зависимости от особенностей клинических проявлений миокардита, чаще всего — с ишемической болезнью сердца, перикардитом, митральным пороком сердца, миокардиодистрофией различного генеза, кардиомиопатиями.
При преобладании жалоб на боли в области сердца и инфарктоподобных изменениях ЭКГ у пожилых лиц отличить миокардит от проявлений ишемической болезни сердца бывает весьма не просто, тем более что обострение последней может быть связано с предшествующей инфекцией (но примерно в 20 раз реже). При обосновании диагноза учитывают следующие отличия:
- боли при миокардите отличаются от приступов стенокардии характером, локализацией в предсердечной области (а не за грудиной), большей продолжительностью (иногда по нескольку часов), отсутствием типичной иррадиации, и за редкими исключениями они не купируются нитроглицерином, хотя могут после его приема уменьшаться;
- динамика интенсивности и частоты болей при миокардите не согласуется с динамикой изменений ЭКГ;
- формирование патологических зубцов Q или QS при миокардите обычно не сочетается с элевацией сегмента ST, характерной для острой фазы инфаркта миокарда;
- при инфаркте левожелудочковая недостаточность и кардиогенный шок в раннем периоде болезни наблюдаются значительно чаще, чем при миокардите;
- уровень в крови кардиоспецифических ферментов, в частности МВфракции КФК, при инфаркте миокарда обычно повышается только в первые 72 ч и быстро снижается в последующие дни, в то время как при миокардите его повышение бывает более длительным (до 2 нед.);
- для стенокардии не характерно повышение СОЭ и уровня белков острой фазы в крови, при инфаркте миокарда лейкоцитоз и СОЭ имеют типичную динамику в первую неделю болезни.
В ряде случаев окончательный диагноз устанавливают только после получения результатов иммунологических исследований и оценки динамики болезни и изменений ЭКГ в течение нескольких дней.
С перикардитом дифференциальный диагноз проводят в случаях выраженной кардиомегалии, заставляющей исключать массивный перикардиальный выпот, и при характерных для фибринозного перикардита постоянных болях в области сердца, иногда усиливающихся в положении на животе и при глубоком дыхании. В последнем случае обычно выслушивается шум трения перикарда, подтверждающий наличие перикардита, но заключение об изолированном характере последнего обосновывают дополнительным исключением поражения миокарда прежде всего по отсутствию изменений ЭКГ, не характерных для перикардита (например, нарушений проводимости); в противном случае устанавливают диагноз миоперикардита. При кардиомегалии массивный выпот в перикардиальную область исключают по отсутствию характерной треугольной тени сердца при рентгенологическом исследовании, но наиболее достоверно — по данным эхокардиографии, с помощью которой можно не только выявить жидкость в полости перикарда, но и приблизительно оценить ее количество.
Митральный порок сердца приходится исключать в случаях, когда появление систолического шума сочетается с преимущественным увеличением левых отделов сердца, имитирующих картину органической митральной недостаточности. В отличие от последней при миокардите систолический шум обычно не примыкает к I тону сердца, изменяется по интенсивности в разные дни и может исчезать после улучшения сократительной функции, на фонокардиограмме он определяется как мезосистолический, часто сочетается с наличием III тона, удлинением интервала Q – I тон. Рентгенологически при миокардите отмечается не повышение, а снижение пульсации контуров сердца, почти не встречаются коромыслоподобные движения между III и IV дугами по левому контуру сердца. Эхокардиография позволяет исключить органическое поражение створок митрального клапана и иногда выявить причину систолического шума (например, функциональный пролапс створки).
Особенно трудной бывает дифференциальная диагностика миокардита и миокардиодистрофии. Тахикардия, одышка, потливость, субфебрилитет, нередко также утомляемость, кардиалгии, ощущение сердцебиений, свойственные миокардиту, могут быть при тиреотоксикозе, диагноз которого облегчается в тех случаях, когда увеличен вольтаж зубцов ЭКГ, повышено систолическое и пульсовое АД; имеются глазные и другие симптомы тиреотоксикоза. В таких случаях правильный диагноз устанавливают только по результатам исследования функции щитовидной железы; подтверждает его положительный эффект при лечении токсического зоба.
Алкогольная миокардиодистрофия в стадии декомпенсации сердца также имеет сходные проявления с идиопатическим миокардитом, и их различие не всегда бывает строго доказательным. По некоторым данным, при алкогольных поражениях миокарда чаще, чем при миокардите, определяются антитела к нервным волокнам миокарда.
Дифференциальный диагноз с кардиомиопатиями проводят у больных с кардиомегалией, нарушениями сердечного ритма и сердечной недостаточностью в тех случаях, когда клинические признаки и биохимические показатели воспаления отсутствуют. Гипертрофические кардиомиопатии относительно легко распознаются с помощью двухмерной эхокардиографии различить тяжелый миокардит и дилатационную кардиомиопатию весьма трудно, часто невозможно даже с помощью исследования биоптатов миокарда. При поражениях сердца, протекающих с гиперэозинофилией, бывает необходимо дифференцировать миокардит, например лекарственный, с эндокардитом Леффлера как проявлением эозинофильного васкулита. Последний наблюдается преимущественно у мужчин, чаще сочетается с легочными инфильтратами; эозинофилия, в отличие от лекарственного миокардита, задолго предшествует признакам поражения сердца.
Лечение миокардитов. Немедикаментозное лечение включает:
- гипоаллергенную диету. Показаны молочные продукты — кефир, сметана, творог, овощи — морковь, тыква; фрукты — печеные яблоки, груши, сливы, крупы, мясо — говядина, крольчатина;
- соблюдение двигательного режима — постельного или полупостельного (в зависимости от распространенности и тяжести воспалительного процесса в миокарде).
Если установлена связь миокардита с инфекцией, назначают антибактериальные препараты в течение 10–15 дней. При отсутствии данных о перенесенной инфекции, хронической очаговой инфекции и достоверных признаках воспаления, аллергических реакций, нарушений иммунитета основу терапии составляют противовоспалительные средства: нестероидные противовоспалительные средства (НПВС), а в тяжелых случаях — глюкокортикоидные гормоны. При хроническом рециливирующем течении ставится вопрос о назначении аминохинолинов (плаквенил, делагил). Длительность назначения НПВС при миокардитах зависит от этиологии, патогенетического варианта, а также характера течения процесса. В настоящее время в мировом медицинском сообществе сформировало мнение и нецелесообразности назначения НПВС. Использование неспецифической противовоспалительной терапии может приводить к ускорению репликации вируса, увеличению повреждения миокарда. НПВС назначают при миокардите средней степени тяжести: диклофенак в начальной суточной дозе 25–50 мг, постепенно ее увеличивают до 100–150 мг, пироксикам 30 мг 1–2 раза в сутки, ибупрофен 400 мг 3 раза в сутки, нимесулид 100 мг 2 раза в сутки.
В случае высокой активности воспалительного процесса, наличия признаков иммунного или аутоиммунного воспаления, при тяжелом миокардите основу противоспалительной терапии составляют глюкокортикостероиды: преднизолон в дозе 60–80 мг/сут. до достижения клинического и лабораторного эффекта, обычно в течение 7–10 дней, в последующем дозу снижают на 2,5–5 мг (в зависимости от начальной дозы) 1 раз в 5–7 дней.
Прогноз при миокардитах зависит от варианта течения. При легких миокардитах отмечается выздоровление пациентов. Исходом миокардита средней степени тяжести может быть выздоровление или дилатация полостей. Пациенты с тяжелым миокардитом имеет высокий риск летального исхода или, как правило, у них происходит трансформация миокардита во вторичную дилатационную кардиомиопатию с неблагоприятным прогнозом.