Методы исследования боли
Содержание страницы
1. Клинические методы
Проблеме исследования боли посвящено большое количество работ, предлагающих различные методические подходы. Однако изучение болевого феномена представляет определенные трудности. Одной из главных проблем является сложность объективного анализа алгического феномена. Попытки объективизировать боль с помощью различных методов предпринимались неоднократно. Регистрация изменений сосудистого тонуса, кровенаполнения сосудов, биоэлектрической активности мозга, электромиографических и термографических параметров, анализ содержания моноаминов и эндорфинов в крови и спинномозговой жидкости и другие исследования лишь указывают на то, что выявляемые нейрофизиологические, гуморальные и вазомоторные сдвиги ассоциированы с болью. Однако эти признаки неспецифичны и в строгом смысле не могут быть критерием объективизации боли.
Большинство разработанных методик, используемых для изучения боли в общемедицинской практике, основывается на субъективной оценке исследуемых, т. е. на ощущениях самого больного. Это в основном психологические и психофизиологические тесты: визуальная аналоговая шкала (ВАШ), цифровые шкалы, метод описательных определений боли, комплексный болевой опросник, определение болевых порогов в актуальной и нейтральной зонах, опросники качества жизни, ведение дневников, альгометрия, проба Труссо – Бонсдорфа и др. Отсутствие объективных методов анализа боли ограничивало возможности глубокого изучения ноцицептивных и антиноцицептивных механизмов при различных алгических феноменах. Однако в последние годы для этого были предложены некоторые новые нейрофизиологические подходы: изучение ноцицептивного флексорного рефлекса (R III), экстероцептивной супрессии произвольной мышечной активности и оценка лазерных вызванных потенциалов. Эти методы в комплексе с другими позволяют вплотную приблизиться к объективной оценке боли и исследованию мозговых систем, участвующих в ее формировании.
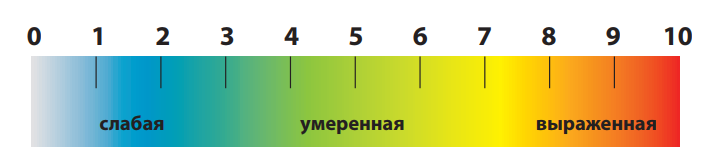
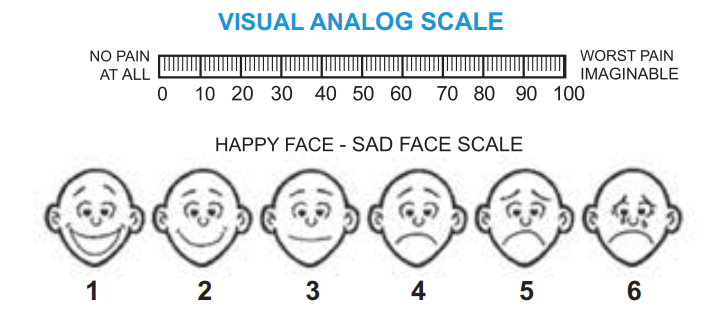
Визуальная аналоговая шкала (ВАШ). По методу ВАШ на отрезке прямой длиной 10 см больной отмечает интенсивность боли. Начало линии слева соответствует отсутствию болевого ощущения, конец отрезка справа – непереносимой боли. Для удобства количественной обработки на отрезке наносят деления через каждый сантиметр (рис. 6). Цифровые шкалы более разнообразны: на одних интенсивность боли обозначается цифрами от 0 до 10, на других – в процентах от 0 до 100. Больной должен обозначать интенсивность боли, зная, что ноль соответствует отсутствию боли, а конечная цифра шкалы – максимально выраженной боли, которую пациент испытывал когда-либо в жизни. У детей используются шкалы с изображением лиц (рис. 7). Метод описательных определений заключается в том, что больному предлагаются определения боли: «легкая», «умеренная»,
«терпимая», «сильная» и «нестерпимая» (обычно не более 10 определений). Пациент должен выбрать определение и подчеркнуть его. Сравнительные исследования показали, что большинство больных предпочитают описательную шкалу, поскольку интенсивность боли выражают прилагательные, а не абстрактные отметки на прямой, не цифры или проценты.
Рисунок 6. Bизуальная аналоговая шкала для взрослых
Рисунок 7. Шкала для определения интенсивности боли у детей
Многомерная оценка боли возможна с использованием МакГилловского болевого опросника, который в русском варианте состоит из 78 слов-дескрипторов (слов, определяющих боль), сведенных в 20 подклассов (субшкал), образующих три главных класса (шкалы): сенсорную, аффективную и эвалюативную. В каждом подклассе дескрипторы расположены по нарастанию интенсивности; обследуемый должен выбрать один из них, наиболее соответствующий его ощущениям. Больного просят дать описание боли, выбрав те или иные дескрипторы в любых (необязательно в каждой) из 20 субшкал, но только один из дескрипторов в соответствующей субшкале. Обработка данных сводится к определению трех показателей:
- Индекс числа выбранных дескрипторов – общее количество выбранных слов.
- Ранговый индекс боли (РИГЕ) – сумма порядковых номеров субдескрипторов в данной субшкале сверху вниз.
- Интенсивность боли определяют путем подсчета слов, описывающих боль в период исследования (в момент предъявления опросника). Каждый показатель может быть подсчитан по всем шкалам целиком либо отдельно для каждой шкалы.
Электрометрическая методика. С помощью предъявления одиночных электрических стимулов проводят определение порогов болевой чувствительности. За порог болевой чувствительности принимают параметры (амплитуду) минимального электрического стимула, сопровождающегося появлением болевого ощущения. Использование этого метода позволяет провести количественную оценку порогов болевой чувствительности, сравнить данные на больной и здоровой сторонах и т. д. С помощью измерения болевых порогов предложено также сопоставление ощущения боли в так называемой актуальной (в области локализации боли) и нейтральной зонах. В актуальной зоне болевые пороги чаще всего снижены.
Опросники качества жизни. С целью оценки интенсивности боли, ее влияния на жизнь, определения эффективности применяемых противоболевых средств проводят также исследование степени жизненной активности пациента. Существует несколько опросников качества жизни. С их помощью оценивают степень активности, работоспособности, чувство усталости, изменения настроения, результативность выполняемой деятельности, эмоциональность (страх, тревога, апатия, возбужденность, гнев, досада и т. п.), длительность этих состояний, соотнесенность их со степенью боли. Все это позволяет косвенно судить о выраженности болевых ощущений. При необходимости более тщательного анализа эмоционально-личностной сферы пациентов, особенно при хронических болевых синдромах, проводят специальное психологическое тестирование: многостороннее исследование личности (МИЛ), определение уровня реактивной и личностной тревожности по тесту Спилбергера, оценка депрессивности по тесту Бека, шкале Гамильтона и др. Эти исследования абсолютно адекватны, поскольку доказаны тесные взаимоотношения между алгическим феноменом, депрессией и тревогой. Опросник DN4. Во Франции был разработан диагностический опросник нейропатической боли (DN4), предназначенный для широкого использования практическими врачами (Didier Bouhassiraa, Nadine Attala et al., 2005) (табл. 1). Он состоит из двух блоков: первый – из семи вопросов – заполняется на основании опроса пациента, второй – из трех вопросов – на основании клинического осмотра. Первый блок позволяет оценить позитивные сенсорные симптомы, такие как спонтанная боль (ощущение жжения; болезненное ощущение холода; ощущение как от ударов током), парестезии, дизестезии (ощущение ползания мурашек, покалывание, онемение, зуд). Второй блок позволяет врачу выявить аллодинию и негативные сенсорные симптомы. Подсчет баллов опросника очень прост: сумма баллов выше 4 означает предположительное наличие у пациента нейропатической боли. Валидность опросника DN4 подтверждена соответствующим исследованием. Он правильно идентифицирует нейропатическую боль у 86% пациентов, а также обладает высоким уровнем чувствительности (82,9%) и специфичности (89,9%). Опросник DN4 переведен на большинство европейских языков, в том числе и на русский.
Таблица 1. Опросник для выявления нейропатической боли DN4
Диагностический опросник нейропатической боли DN4
Didier Bouhassiraa, Nadine Attala et al. Pain, 2005, 114: 29–36
Пожалуйста, заполните этот опросник, отметив галочкой один ответ для каждого пункта в приведенных ниже 4 вопросах.
| Cобеседование с пациентом | ||
| ВОПРОС 1.
Соответствует ли боль, которую испытывает пациент, одному или нескольким из следующих определений? |
Да | Нет |
| 1. Ощущение жжения | | |
| 2. Болезненное ощущение холода | | |
| 3. Ощущение как от ударов током | | |
| ВОПРОС 2.
Сопровождается ли боль одним или несколькими из следующих симптомов в области ее локализации? |
Да | Нет |
| 4. Пощипыванием, ощущением ползания мурашек | | |
| 5. Покалыванием | | |
| 6. Онемением | | |
| 7. 3yдом | | |
| Осмотр пациента | ||
| Bопрос 3.
Локализована ли боль в той же области, где осмотр выявляет один или оба следующих симптома? |
Да | Нет |
| 8. Пониженная чувствительность к прикосновению | | |
| 9. Пониженная чувствительность к покалыванию | | |
| Bопрос 4.
Можно ли вызвать или усилить боль в области ее локализации? |
Да | Нет |
| 10. Проведя в этой области кисточкой | | |
Сумма баллов (количество ответов «Да»): если сумма составляет 4 и более баллов, это указывает на то, что боль у пациента является нейропатической или имеется нейропатический компонент боли (при смешанных ноцицептивно-нейропатических болевых синдромах).
Опросник PainDetect. Он был разработан и валидизирован в Германии в ходе многоцентрового исследования с участием 392 пациентов с нейропатической и ноцицептивной болью, а также с болью в спине (Freynhagen, 2005, 2006) (рис. 8). Опросник предназначен для заполнения врачом и объединяет в себе схему распределения болевых расстройств в виде картинки со шкалой ВАШ и опросником, направленным на выявление спонтанных и вызванных симптомов нейропатической боли. Также при помощи рисунка оценивается характер течения боли: постоянный, приступообразный, постоянный с приступами и т. д. Опросник наиболее полно отражает все возможные параметры боли и позволяет очень наглядно отслеживать картину болевого синдрома в динамике. Его диагностическая ценность равна 83%. Опросник Pain DETECT, как и DN4, переведен на русский язык и прошел лингвистическую валидацию. В заключение хочется отметить, что ни один из перечисленных опросников не подменяет детального клинического осмотра пациента. Эти методы предлагается использовать в качестве удобного вспомогательного средства диагностики и дифференциальной диагностики болевых синдромов. Кроме того, некоторые из них могут использоваться для оценки результатов терапии.
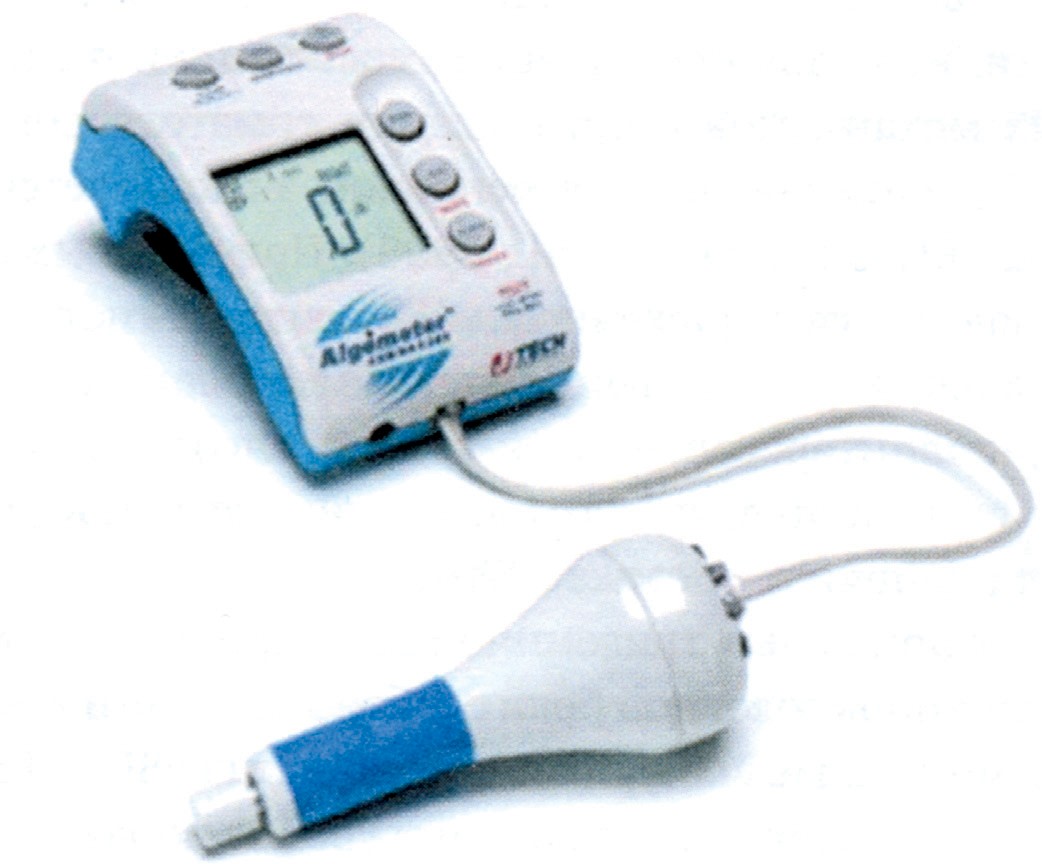
Альгометрия. Метод альгометрии заключается в количественном измерении субъективного отчета о боли при предъявлении нарастающих по интенсивности болевых стимулов.
Существуют различные типы альгометров, среди которых механический тип является наиболее распространенным (рис. 9). Исследователь с помощью альгометра (прибор в виде металлического стержня с пружиной и датчиком) надавливает на определенные точки тела. Сила давления отражается цифровым индикатором. При ощущении нестерпимой боли пациент нажатием на специальную кнопку фиксирует цифровое значение, соответствующее силе механического давления, при котором возникла боль. Обычно исследуется множество точек, что позволяет оценить зоны локализации максимальной боли. Этот метод нашел наибольшее применение в исследовании миофасциальной боли различной локализации.
Рисунок 8. Опросник PainDetect
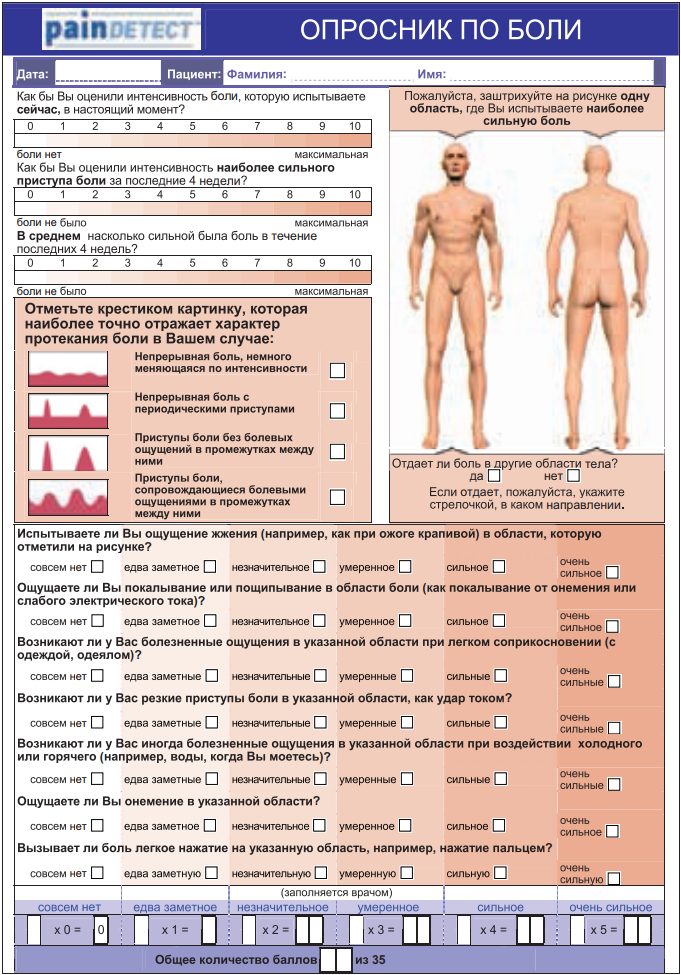
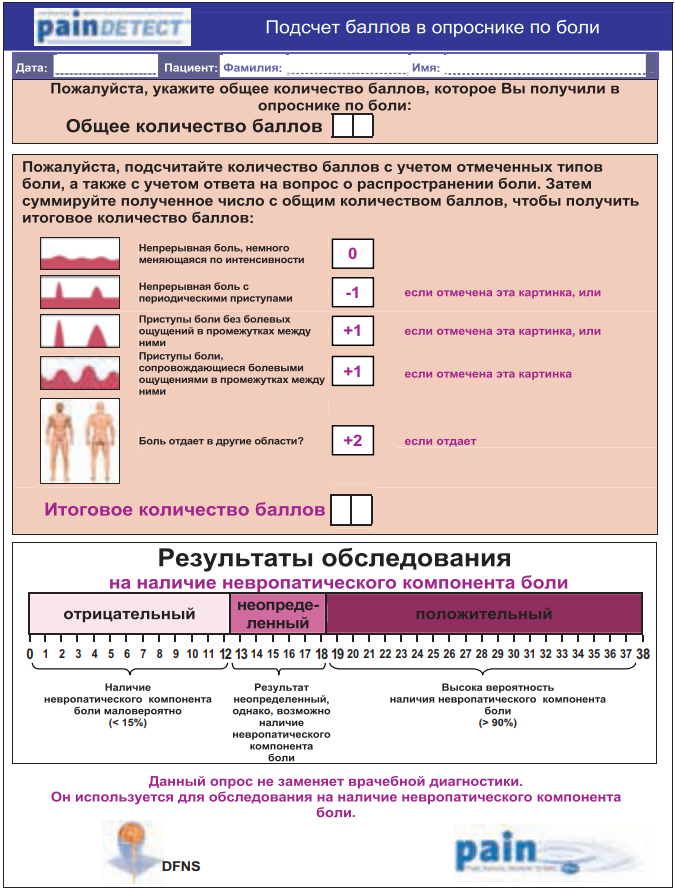
Рисунок 9. Альгометр
2. Нейрофизиологические методы
Для анализа состояния ноцицептивных систем ряд авторов предлагают использование нейрофизиологических методик исследования защитных рефлексов. Существует несколько рубрификаций защитных рефлексов. В зависимости от места стимуляции различают плантарные, абдоминальные, корнеальные рефлексы и т. д. По характеру рефлекторного мышечного ответа можно выделить флексорные, экстензорные, мигательный рефлексы. Учитывая рефлекторные пути, говорят о кожно-мышечных, кожно-спинальных, спино-бульбо-спинальных и полисинаптических рефлексах. Наконец, в зависимости от воздействия на периферические рецепторы различают ноцицептивные (активация рецепторов А-дельта- и С-волокон) и экстероцептивные (активация рецепторов других типов волокон) рефлексы. Биологическое значение защитных рефлексов заключается в рефлекторном мышечном ответе, направленном на устранение повреждающего агента и защиту организма от его воздействия.
В исследовании алгических феноменов используют исследование корнеального, мигательного (Rossi В., Vignocchi M.G., 1993; Ellrich J. et al., 1997), брюшных (Satomi К., 1993) и тригемино-цервикального рефлексов (Ertekin С. et al., 1996). Этот выбор обусловлен тем, что определенные ответы этих рефлексов связаны с активацией ноцицептивных периферических структур (рецепторов А-дельта- и С-волокон). Например, в роговице представленность этих рецепторов является доминирующей, и поэтому корнеальный рефлекс считают, по сути, ноцицептивным. Полагают, что в мигательном рефлексе поздние ответы (R2 и R3) также связаны с активацией ноцицептивных волокон. При исследовании брюшных рефлексов было показано, что стимуляция ноцицептивных волокон кожи брюшной стенки вызывает появление ранних рефлекторных ответов. При стимуляции первой ветви тройничного нерва в m. sternocleidomastoideus регистрируют три ответа (С1, С2 и СЗ). Мышечный ответ СЗ возникает при ноцицептивной стимуляции. Исследования тригемино-цервикального рефлекса при головной боли показали укорочение латенций ответов при мигрени, снижение амплитуд при цервикогенной боли и отсутствие изменений при хронической головной боли напряжения и абузусной головной боли (Abstracts-on-disk. 8 th Congress of the Intetnational Headache Society, Amsterdam, 1997).
Таким образом, анализ параметров рефлекторных ответов (пороги, латентность, амплитуды, длительность, габитуация) защитных рефлексов, реализуемых при участии периферических ноцицепторов, может быть полезным как в оценке механизмов формирования боли на различных уровнях нервной системы, так и в оценке интегративных мозговых механизмов контроля боли.
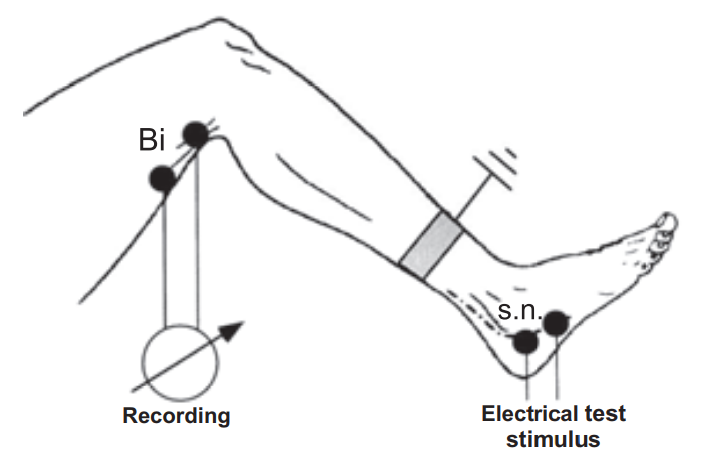
Методика исследования ноцицептивного флексорного рефлекса (НФР). Он, как и корнеальный, мигательный, брюшные рефлексы, относится к группе защитных, однако обладает наибольшей информативностью. НФР интересен тем, что позволяет объективно и количественно оценить порог боли у человека. Доказано, что у здорового есть тесная связь между порогом субъективного болевого ощущения и порогом возникновения этого рефлекса (Wilier J.C., 1983; Sandrini G. et al., 1993). Этот рефлекс также позволяет оценить состояние ноцицептивных и антиноцицептивных систем, изучить роль и влияние различных медиаторов, вовлеченных в контроль боли. Кроме того, он может быть использован для изучения патофизиологии различных клинических синдромов, характеризующихся хронической болью или измененной болевой перцепцией. Описание метода. НФР можно вызвать как с нижних, так и с верхних конечностей. Однако более распространено исследование с нижних конечностей. Испытуемый должен сидеть в удобном кресле, ноги максимально расслаблены, колени согнуты под углом 130°, а стопа в голеностопном суставе должна находиться под углом 90° (рис. 10). Для уменьшения эмоционального напряжения необходимо проинформировать испытуемого об условиях эксперимента. Стимулирующие электроды располагают позади лодыжки или несколько ниже по ходу малоберцового нерва на расстоянии 2 см друг от друга, катод – проксимальнее, анод – дистальнее.
Регистрирующие электроды располагают на брюшке musculus biceps femoris capitis brevis (катод) и на сухожилии этой мышцы (анод). Заземляющий электрод располагают на середине между стимулирующими и регистрирующими электродами. В качестве стимула используют тренд (пачки) стимулов общей длительностью 20 мс с внутренней частотой 300 Гц и длительностью каждого стимула 1 мс.
Во избежание габитуации пачки стимулов рекомендуется подавать в нерегулярном порядке. Исследование начинают с подачи стимулов малой интенсивности, постепенно ее увеличивая, и наблюдают за появлением мышечных ответов.
При появлении ответа фиксируют его порог (порог рефлекса (Пр)), т. е. величину электрического тока, при которой он появился. Фиксируют также порог субъективной боли (Порог боли (Пб)), т. е. величину электрического стимула, при которой пациент впервые указывает на появление локализованной острой боли в области расположения стимулирующих электродов. У здоровых Пб и Пр обычно совпадают или первый несколько ниже второго.
Рисунок 10. Расположение электродов для исследования HФР
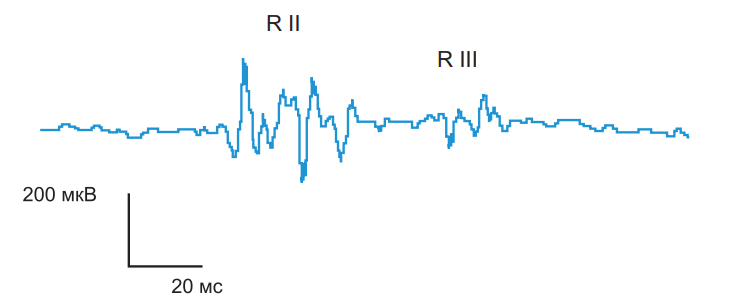
Для точного определения соотношения между болью и Пр вычисляют коэффициент Пб/Пр, который у здоровых равен примерно 0,9–1,0. Снижение этого соотношения указывает на несоответствие между субъективной оценкой боли и активностью ноцицептивных и антиноцицептивных механизмов. НФР имеет два последовательных компонента: R II и R III (рис. 11).
Латенция R II ответа короткая (40–70 мс при стимуляции икроножного нерва). Этот ответ можно получить только при неболевой стимуляции, воспринимаемой как легкое покалывание. Латенция R III ответа более длинная (90–130 мс), и его появление связано с локальным болевым ощущением в месте стимуляции. Ответ R II появляется обычно первым, при последующем увеличении силы тока возникает ответ R III. Пороговыми величинами, согласно Wilier (1983), являются 5,0±0,6 мА для R II и 10,0±1,0 мА для R III ответов (Пр); согласно Sandrini et al. (1993) – 9,6±0,6 мА для R II и 13,1±4,4 мА для R III (Пр). Указывается, что различия в данных могут объясняться различиями в приборах, использованных для исследования. Возможно также использование и одиночных импульсов, однако при этом требуется высокая интенсивность электрического тока. В наших исследованиях при применении одиночных стимулов параметры Пб составили 92±11 В, а Пр – 102±13 В. Следует учесть, что подача очень сильных стимулов не должна вызывать дистресс, поэтому необходимо следить, чтобы испытуемый был постоянно расслаблен. Из этих же соображений межстимульные интервалы также должны быть продолжительными. Можно использовать мониторирование некоторых вегетативных параметров (частота дыхания, частота сердечных сокращений) для выявления влияния эмоционального дистресса. Это очень важно, поскольку дистресс, активируя опиоидные системы, ингибирует НФР.
Рисунок 11. Ноцицептивный флексорный рефлекс
При планировании записи необходимо учитывать циркадные флюктуации порогов этих рефлексов, поэтому контрольную и фоновую запись нужно проводить в одно и то же время дня.
Величина Пр у здоровых испытуемых тесно связана с субъективным ощущением боли. Таким образом, этот метод представляет интерес для количественной оценки боли. Для измерения субъективной болевой чувствительности можно использовать ВАШ. Изменяя интенсивность стимулов, можно получить кривую субъективной чувствительности, соответствующую интенсивности стимула. Показано, что у здоровых эта кривая совпадает или перекрывает кривую, полученную при измерении R III ответа, что еще раз подтверждает прямую корреляцию между субъективным болевым ощущением и порогом появления R III ответа. НФР главным образом связаны с активацией А-дельта-волокон. Согласно классификации Lloyd эти волокна относятся к группе III, поэтому НФР также иногда называют R III рефлекс. Тем не менее при определенных модальностях стимула А-альфа- и А-бета-волокна также могут проводить стимулы, вызывающие ноцицептивные рефлексы.
Лазерные вызванные потенциалы (ЛВП). Одним из новых методов в изучении нейрофизиологии боли является исследование ЛВП. В 1976 г. Carmon et al. продемонстрировали появление церебрального потенциала в области вертекса при стимуляции кожи рук здоровых испытуемых короткими импульсами инфракрасного лазера. Оказалось, что амплитуда этого потенциала коррелирует с интенсивностью болевых ощущений. Подобные корковые ответы регистрировали и раньше, например, при стимуляции пульпы зуба, однако использование лазера сделало возможным стандартизацию стимула и использование разных участков тела для стимуляции.

Рисунок 12. Aппарат для исследования лазерных вызванных потенциалов
Механизм действия лазерной инфракрасной стимуляции заключается в генерировании в коже тепловых импульсов, чрезвычайно быстро повышающих температуру кожи (500 °С/сек), что вызывает активацию интраэпидермально расположенных ноцицепторов (рис. 12, 13). Интенсивное термическое воздействие на ноцицепторы вызывает мощный синхронный афферентный поток импульсов, достигающих коры головного мозга, что при регистрации выглядит как двухфазный негативно-позитивный потенциал. Специальными исследованиями у людей и животных было показано, что инфракрасная лазерная стимуляция селективно активирует афферентные А-дельта- и С-волокна (главные периферические ноцицептивные афференты), а амплитуда потенциала позитивно коррелирует с болевыми ощущениями, испытываемыми во время стимуляции.
Тепловые вызванные потенциалы. Современные достижения в области медицинской техники позволяют тестировать функции тонких волокон путем их избирательной стимуляции тепловыми стимулами с помощью устройства Contact Heat Evoked Potential Stimulator (CHEPS, Medoc Ltd, Ramat Yishai, Israel). Эта методика получила название тепловых вызванных потенциалов (ВП) или CHEPS (рис. 14).
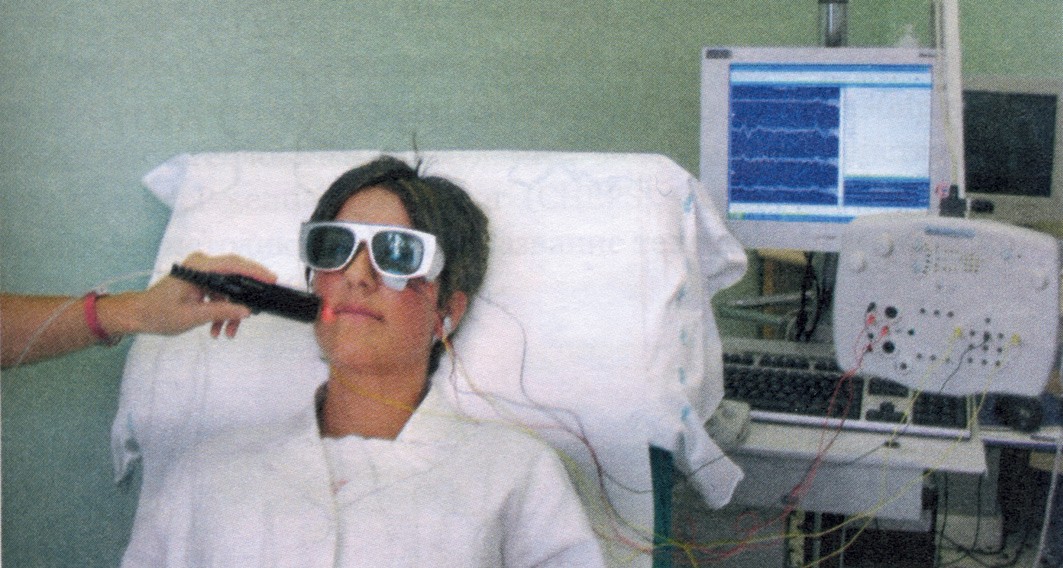
Рисунок 13. Процедура исследования лазерных вызванных потенциалов
Рисунок 14. Aппарат для исследования тепловых вызванных потенциалов
Уникальность CHEPS состоит в его способности нагреваться и остывать практически мгновенно (70 °C/сек). Именно благодаря этой инновационной технологии пользователи, применяя специальный термодатчик/ стимулятор размером 24 мм х 24 мм, впервые получили возможность проводить исследования обширных участков кожного покрова. Система позволяет легко проводить селективную стимуляцию А-дельта- и С-волокон. CHEPS может служить также инструментом объективной оценки болевой чувствительности как для исследования динамических изменений в системе восприятия боли человека, так и для оценки результата лечения и приема различных препаратов. Благодаря великолепной системе контроля температуры CHEPS осуществляет быструю тепловую стимуляцию с заданной температурой, в результате которой селективно активируются различные группы сенсорных волокон и записываются ВП мозга (рис. 15).
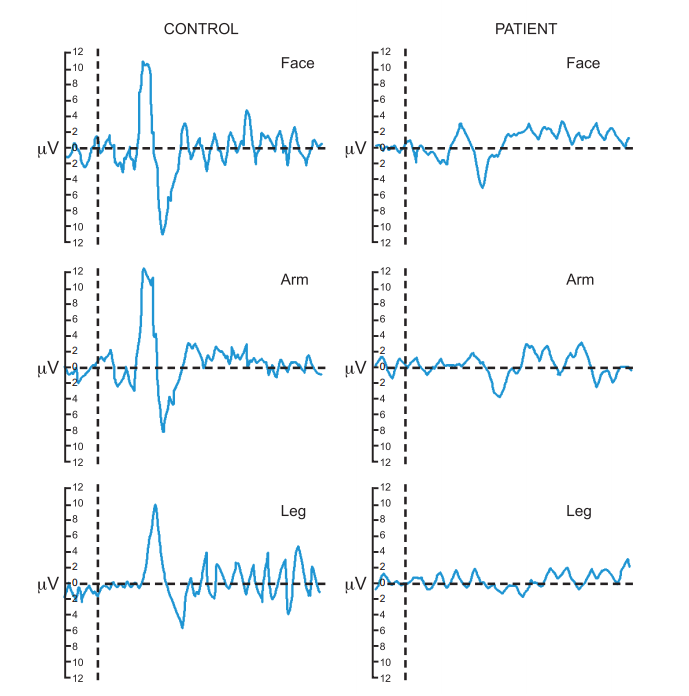
ВП мозга в ответ на такую стимуляцию регистрировали у больных с заболеваниями нервной системы (Kakigi R. et al., 1992; Treede R.D., 2003; Duncan D. et al., 2007; Warbrick T. et al., 2009). Было показано, что при структурном поражении проводников болевой и температурной чувствительности ответы мозга на избирательную стимуляцию тонких волокон исчезают, а у больных с мигренью и фибромиалгией, напротив, могут повышаться.
3. Методы нейровизуализации
Позитронно-эмиссионная томография (ПЭТ) не является методом исследования болевых систем, однако позволяет судить о метаболизме мозга и активности его различных отделов при болевых синдромах (Cesaro P., 1991; Ladarola M.J. et al., 1995). В проведенных исследованиях ПЭТ у больных с мигренью во время приступа было выявлено достоверное усиление регионарного кровотока в стволовых структурах (околоводопроводное вещество, ретикулярная формация среднего мозга, голубое пятно) преимущественно контралатерально по отношению к стороне боли (Weiller С. et al., 1995). Важно отметить, что усиленный кровоток в стволе мозга сохранялся и после того, как ввели суматриптан и приступ мигрени был полностью купирован. При этом в межприступном интервале у этих больных изменений регионарного кровотока не отмечено.
Рисунок 15. Tепловые вызванные потенциалы (CHEPS) в норме (control) и у пациента с сенсорной полиневропатией тонких волокон (patient)
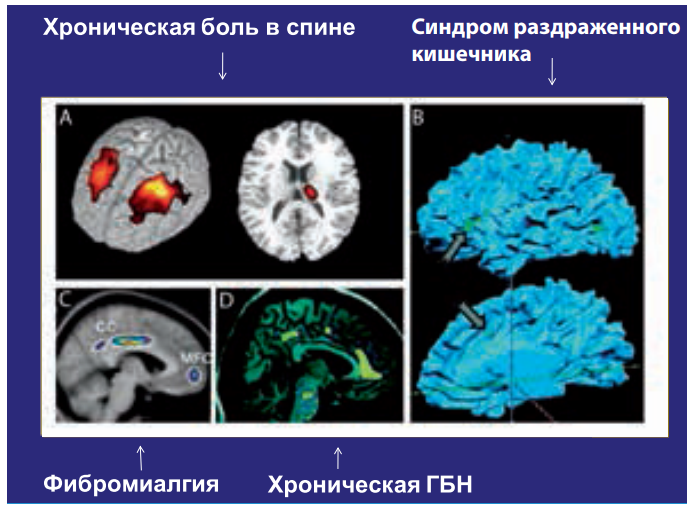
У больных с кластерной головной болью при проведении ПЭТ до, во время и после болевого периода, напротив, никаких изменений не выявлено, что свидетельствует о различных церебральных механизмах мигрени и кластерной цефалгии (Hsieh J.C., Hannerz J., Ingvar M., 1996). Сложность в трактовке данных ПЭТ без соотнесения с другими методами заключается в том, что усиление регионарного кровотока может быть результатом процессов различного уровня активации. Исследования ПЭТ при таламическом синдроме обнаруживают снижение метаболизма глюкозы в заднелатеральной части зрительного бугра и корковых отделах постцентральной области при корковой активации в прецентральной зоне стороны поражения. Предполагается, что при таламическом синдроме важную роль в генезе боли имеют вторичные корковые нарушения в зоне центральной борозды. В течение последних 5 лет были проведены исследования ПЭТ у здоровых людей при предъявлении ноцицептивных стимулов. В большинстве работ наиболее закономерно отмечено билатеральное повышение активности в области передних отделов поясной извилины (Derbyshire S.W., Jones А.К., 1998). Обнаруженные с помощью функциональной МРТ в ряде исследований у пациентов с хронической болью морфометрические изменения в различных отделах головного мозга на сегодняшний день трактуются как явления патологической нейропластичности (рис. 16). Однако клиническая значимость этих нарушений пока остается неизученной. Есть предварительные данные о том, что применение комплексного мультимодального биопсихосоциального подхода в терапии (например, при фибромиалгии) приводит к регрессу этих нарушений, что коррелирует с клиническим улучшением.
Рисунок 16. Морфометрические изменения в головном мозге при хронической боли