Боль. Лечение и фармакотерапия боли
Содержание страницы
1. Парацетамол
Парацетамол – один из самых популярных анальгетиков в мире. Начиная с 50-х гг. ХХ в. быстро завоевал симпатии врачей и пациентов. После десятилетий применения в клинике механизм антиноцицептивного эффекта парацетамола стал понятным. Ингибирование синтеза простагландинов (ПГ) – по-прежнему наиболее распространенная гипотеза относительно механизма его действия, тем не менее очевидно, что он не единственный. На собаках, к примеру, было установлено, что изоформа циклооксигеназы (ЦОГ) 3 необходима для синтеза простагландинов и ингибируется парацетамолом, но это не относится к грызунам и человеку. На основе экспериментальных исследований на животных было высказано предположение, что антиноцицептивный эффект парацетамола может быть по крайней мере частично опосредован через активацию серотонинергического антиноцицептивного пути на уровне головного или спинного мозга.
Значимость этого механизма, расположение и конкретизацию субтипов 5-НТ рецепторов еще требуется установить. Другие недавно проведенные исследования на крысах показали, что парацетамол косвенно стимулирует спинномозговые 5-НТ1А-рецепторы, которые в свою очередь регулируют некоторые механизмы второго порядка, включающие нейрональную внеклеточную сигнал-регулируемую киназу (ERK1/2), а также на уровне спинного мозга рецепторы к гормону роста и инсулиноподобному фактору роста-1. Возможность осуществления этого механизма у людей не установлена. В головном и спинном мозге парацетамол ацетилирует и конъюгирует с арахидоновой кислотой, образуя N-арахидоноилфеноламин (AM404), который имеет множество потенциально анальгетических эффектов на клеточном уровне. Было предположено, что периферические антиноцицептивные эффекты парацетамола, установленные на экспериментальных моделях боли, опосредуются через каннабиоидную систему. В периферических тканях клеточные пероксидазы нейтрализуют влияние парацетамола на ЦОГ, что объясняет практически полное отсутствие противовоспалительного эффекта. Отсутствие блокирующего влияния на синтез простагландинов обусловливает также отсутствие у парацетамола отрицательного влияния на слизистую оболочку ЖКТ и водно-солевой обмен.
Парацетамол обладает умеренной анальгетической активностью, однако редко вызывает нежелательные эффекты. Это позволило ассоциациям ревматологов Европы (EULAR) и США (ACR) рекомендовать парацетамол как препарат первой линии для симптоматической терапии ряда ревматических заболеваний, прежде всего остеоартроза. Однако он существенно уступает по своей эффективности НПВП и в нашей стране для лечения ревматических болезней используется достаточно редко (обычно в качестве дополнительного анальгетика).
Парацетамол показан при мышечно-скелетной боли слабой и умеренной выраженности, мигрени, зубной боли, альгодисменорее, постоперационной боли, остеоартрозе.
Парацетамол не является «конкурентом» НПВП или опиоидов. Наиболее рационально воспринимать этот препарат в качестве необходимой составной части комплексной противоболевой терапии. Ведь механизм его действия отличается от механизма других анальгетиков, а значит, их комбинированное использование в сравнении с монотерапией должно обеспечивать больший терапевтический успех. Это доказывает опыт применения комбинации парацетамола с опиоидными анальгетиками или НПВП при зубной боли, постоперационной боли и при остеоартрозе. При остеоартрозе такая терапия позволяет не только усилить лечебное действие, но и снизить дозу НПВП. Это очень важно с точки зрения снижения риска лекарственных осложнений, т. к. есть прямая зависимость между дозой НПВП и частотой развития серьезных побочных эффектов.
Для взрослых и подростков старше 12 лет (масса тела более 40 кг) максимальная разовая доза парацетамола – 1 г, максимальная суточная доза – 4 г. Для детей максимальная разовая доза – 10–15 мг/кг, максимальная суточная – до 60 мг/кг. Кратность назначения – до 4 раз в сутки. Максимальная продолжительность лечения – 5–7 дней. В последние годы появились данные о гепатотоксическом действии парацетамола при его умеренной передозировке, при назначении парацетамола в высоких терапевтических дозах и одновременном приеме алкоголя или индукторов микросомальной ферментной системы печени Р-450 (антигистаминные препараты, глюкокортикоиды, фенобарбитал, этакриновая кислота). Однако при использовании терапевтических доз парацетамола (до 4 г/сут) вероятность развития серьезных побочных эффектов со стороны печени и почек представляется достаточно низкой.
2. Нестероидные противовоспалительные препараты
В 1971 г. группа исследователей из Великобритании во главе с J. Vane открыли основной механизм действия НПВП, связанный с ингибицией активности ЦОГ – ключевого фермента метаболизма арахидоновой кислоты, предшественника ПГ.
Было показано, что именно антипростагландиновая активность НПВП лежит в основе их противовоспалительного, жаропонижающего и анальгетического действия. В 1990-е гг. было открыто существование двух изоформ ЦОГ: структурного изофермента (ЦОГ-1), регулирующего продукцию ПГ, участвующих в обеспечении нормальной (физиологической) функциональной активности клеток, и индуцируемого изофермента (ЦОГ-2), экспрессия которого регулируется иммунными медиаторами (цитокинами), принимающими участие в развитии иммунного ответа и воспаления. В 1994 г. J. Vane сформулировал гипотезу, согласно которой противовоспалительное, анальгетическое и жаропонижающее действие НПВП связано с их способностью ингибировать ЦОГ-2, в то время как наиболее часто встречающиеся побочные эффекты (поражение ЖКТ, почек, нарушение агрегации тромбоцитов) связаны с подавлением активности ЦОГ-1. Это создало предпосылки для создания нового класса НПВП, обладающих способностью селективно ингибировать ЦОГ-2, применение которых может сделать лечение этими препаратами более безопасным. В болеутоляющем действии НПВП не исключен и центральный механизм. Он связан с угнетением синтеза ПГ, которые образуются в ЦНС. Представители широкого класса НПВП различаются как по фармакокинетическим, фармакодинамическим параметрам, так и по отношению к ингибированию ЦОГ-1 и ЦОГ-2 (табл. 12 и 13). Сегодня общепринятым является положение о том, что эффективность всех НПВП в отношении уменьшения боли примерно одинакова, а степень безопасности определяется их отношением к ферментам ЦОГ-1 и ЦОГ-2. Так, большая селективность НПВП в отношении ЦОГ-1 ассоциирована с риском желудочно-кишечных осложнений, а селективность в отношении ЦОГ-2 – с риском кардиоваскулярных нежелательных явлений. Некоторые НПВП могут назначаться 1 раз в день, что намного удобнее при необходимости длительного лечения. Поскольку НПВП обладают
«эффектом потолка», увеличение дозы после определенного порогового значения не усиливает обезболивающего эффекта, хотя может увеличить его продолжительность (табл. 14).
Таблица 12. Группы НПВП (Насонов Е.Л., 1999)
| I. Производные кислот | |
| Арилкарбоновые кислоты | |
| Салициловая кислота | Аспирин Дифлунисал Трисалицилат Бенорилат Салицилат натрия |
| Атраниловая кислота (фенаматы) | Флуфенамовая кислота Мефенамовая кислота Меклофенамовая кислота |
| Арилалкановые кислоты | |
| Арилуксусная кислота | Диклофенак Фенклофенак Алклофенак Фентиазак |
| Гетероарилуксусная кислота | Толметин Зомепирак Клоперак
Кеторолака триметамин |
| Индол/инденуксусные кислоты | Индометацин Сулиндак Этодолак Ацеметацин |
| Арилпропионовая кислота | Ибупрофен Флурбипрофен Кетопрофен Напроксен Оксапрозин Фенопрофен Фенбуфен Супрофен Индопрофен
Тиапрофеновая кислота Беноксапрофен Пирпрофен |
| Эноликовая кислота | |
| Пиразолидиндионы | Фенилбутазон Оксифенилбутазон Азапропазон Фепразон |
| Оксикамы | Лорноксикам Пироксикам Изоксикам Судоксикам Мелоксикам |
| II. Некислотные производные | |
| Проквазон Тиарамид Буфексамак Эпиразол Набуметон Флюрпроквазон Флуфизон Тиноридин Колхицин | |
| III. Комбинированные препараты | |
| Артротек (диклофенак + мизопростол) | |
Таблица 13. Классификация НПВП по селективности в отношении различных форм циклооксигеназы
| Степень селективности к ЦОГ-1 или ЦОГ-2 | Название препарата |
| Выраженная селективность в отношении ЦОГ-1 | Ацетилсалициловая кислота Индометацин Кетопрофен Пироксикам |
| Умеренная селективность в отношении ЦОГ-1 | Диклофенак Ибупрофен Напроксен и др. |
| Примерно равноценное ингибирование ЦОГ-1 и ЦОГ-2 | Лорноксикам |
| Умеренная селективность в отношении ЦОГ-2 | Мелоксикам Нимесулид Набуметон |
| Выраженная селективность в отношении ЦОГ-2 | Эторикоксиб Целекоксиб Вальдекоксиб Рофекоксиб |
Главное отличие применения НПВП в ревматологической практике – необходимость их длительного приема пациентами, поэтому наиважнейшим является вопрос выбора безопасного препарата. На рисунках 19 и 20 представлены алгоритмы применения НПВП в ревматологической практике (Насонов Е.Л., Каратеев А.Е.).
В неврологической практике НПВП чаще всего используют для лечения острой боли при мигрени, ГБН, миофасциальных и мышечно-тонических синдромах, радикулопатии, фасеточной артропатии, дисфункции крестцово-подвздошного сочленения, туннельных синдромах. Поскольку вышеуказанные болевые синдромы относятся в основном к ноцицептивному типу боли и обусловлены различными механизмами воспаления в периферических тканях, именно НПВП являются приоритетными препаратами для фармакотерапии. Однако существенными отличиями применения НПВП в неврологической практике являются их своевременное назначение и краткосрочность. В отличие от терапии ревматологических пациентов, у которых НПВП используют месяцами и годами, при лечении острой боли нет необходимости проводить длительные курсы НПВП-терапии. Главными задачами являются как можно более быстрое купирование острой боли, уменьшение тревоги и восстановление функции за счет плавного внедрения продуманной программы психологической поддержки и физической активности.
Таблица 14. Дозы НПВП
| Группа / лекарственный препарат | Доза (мг) | Кратность приема | Максимальная суточная доза (мг) |
| Производные пропионовой кислоты | |||
| Фенопрофен | 200–600 | 2–4 | 3200 |
| Флурбипрофен | 100 | 2–3 | 300 |
| Ибупрофен | 400–800 | 2–6 | 3200 |
| Кетопрофен | 50–200 | 1–3 | 300 |
| Напроксен натрия | 275–550 | 2–4 | 1375 |
| Напроксен | 50–500 | 2–3 | 1500 |
| Оксапрозин | 600–1200 | 1–2 | 1200 |
| Кеторолак | 10 | 2–4 | 40 |
| Производные уксусной кислоты | |||
| Диклофенак | 50–75 | 2–3 | 200 |
| Этодолак | 300–600 | 2–3 | 1200 |
| Индометацин | 25–75 | 2–4 | 200 |
| Сулиндак | 200 | 2 | 400 |
| Толметин | 200–600 | 2–4 | 2000 |
| Фенаматы (производные аминобензойной кислоты) | |||
| Меклофенамат | 50–100 | 2–6 | 400 |
| Мефенаминовая кислота | 250 | 4 | 100 |
| Оксикамы | |||
| Лорноксикам | 8–16 | 2 | 16 |
| Пироксикам | 10–20 | 1–2 | 20 |
| Мелоксикам | 7,5 | 1 | 15 |
| Производные салициловой кислоты | |||
| Сальсалат | 500–750 | 2 | 1500 |
| Дифлунисал | 250–500 | 2 | 1000 |
| Трисалицилат | 500–1000 | 2 | 3000 |
| Нафтилалконы | |||
| Набуметон | 500–700 | 1–2 | 1500 |
| Коксибы | |||
| Целекоксиб | 100–200 | 1–2 | 800 |
| Рофекоксиб | 12,5–50 | 1–2 | 50 |
| Эторикоксиб | 60–120 | 1 | 120 |
| Сульфонанилиды | |||
| Нимесулид | 100 | 2 | 200 |
Рисунок 19. Алгоритм применения НПВП при воспалении суставов
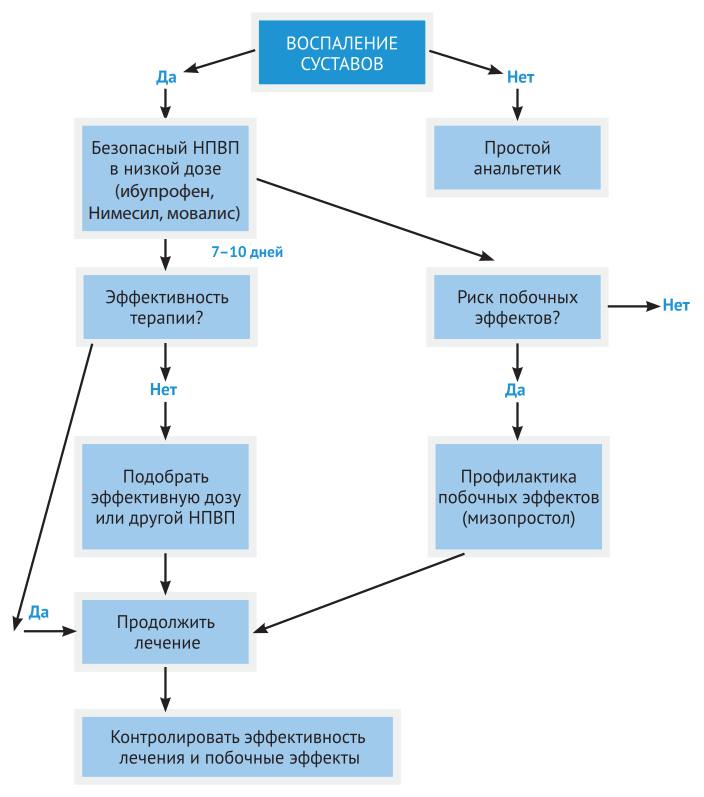
Рисунок 20. Выбор НПВП с учетом риска лекарственных осложнений
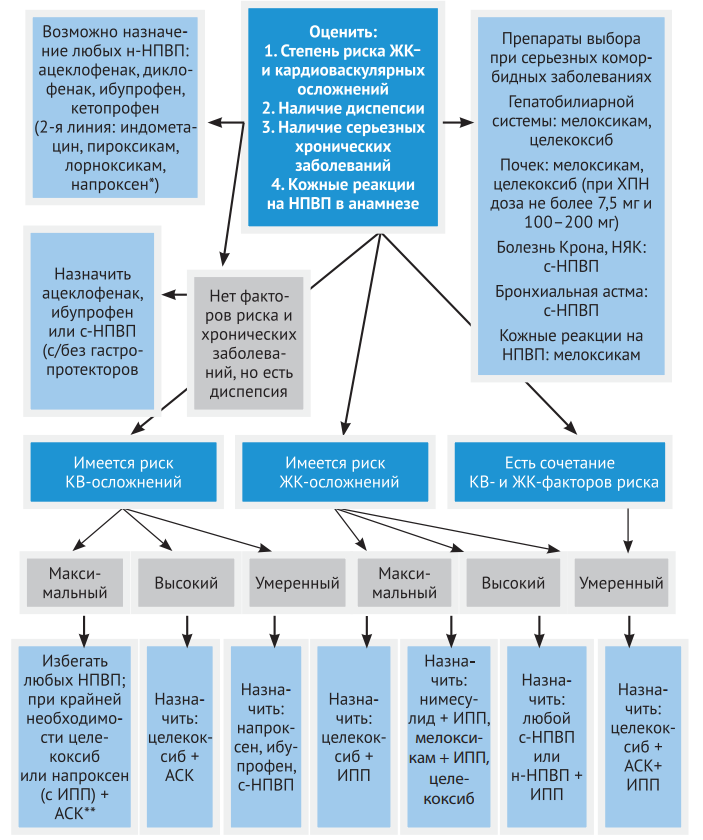
Независимо от области применения особенно важными остаются вопросы безопасности применения НПВП. Это связано с тем, что даже кратковременный прием этих препаратов в небольших дозах может приводить к развитию побочных эффектов, которые в целом встречаются примерно в 25% случаев, а у 5% больных могут представлять собой серьезную угрозу для жизни. Особенно высок риск побочных эффектов у людей пожилого и старческого возраста, которые составляют более 60% потребителей НПВП. Особенно опасными являются гастропатии, кардиоваскулярные осложнения, гепатотоксичность и сенситивный эффект.
Механизм НПВП-индуцированных гастропатий складывается из локальных и системных эффектов ингибирования ЦОГ-1. Самыми частыми побочными эффектами НПВП являются диспептические явления: тошнота и рвота. НПВП-гастропатия определяется как патология верхних отделов ЖКТ, возникающая в связи с приемом НПВП и характеризующаяся повреждением слизистой оболочки (развитие эрозий, язв и их осложнений – желудочно-кишечное кровотечение, перфорация и нарушение проходимости ЖКТ). Увеличивают риск гастропатии возраст, наличие в анамнезе язвенной болезни, желудочно-кишечного кровотечения, прием стероидов.
Большинство исследований свидетельствует, что кардиоваскулярный риск при приеме НПВП имеет значение только для страдающих кардиоваскулярными заболеваниями, по фатальным последствиям он значительно ниже гастроинтестинального риска. В настоящее время получены убедительные клинические данные о том, что умеренное увеличение риска кардиоваскулярных осложнений является классспецифическим эффектом НПВП и не зависит от их селективности по отношению к ЦОГ-2. Повышение уровня печеночных ферментов является класс-зависимым побочным эффектом НПВП. Но в целом риск гепатопатий среди пациентов, принимающих НПВП, крайне мал. Подсчитано, что риск серьезных гастродуоденальных осложнений (кровотечение и перфорация) в 10 раз выше, чем гепатотоксичность. В большинстве случаев повышение уровня печеночных ферментов возникает у пожилых пациентов или больных, имеющих в анамнезе нарушения со стороны печени.
Наиболее известной гиперсенситивной реакцией является респираторный тип реакции (бронхоспазм или «аспириновая астма»). Гиперсенситивность к АСК встречается у 5–20% пациентов, страдающих астмой. У этих больных, как правило, могут развиваться перекрестные реакции с другими НПВП, по химической структуре отличающимися от АСК, но в значительной степени блокирующими ЦОГ-1 (например, индометацин, напроксен, кетопрофен). В значительной степени гиперсенситивные реакции связаны с ЦОГ-1-ингибицией. Ингибиторы ЦОГ-2 не обладают перекрестной реактивностью с АСК и прочими неселективными НПВП и не индуцируют приступы «аспириновой астмы», поэтому их можно рассматривать как препараты выбора у данной категории пациентов.
В 2015 г. были опубликованы клинические рекомендации «Рациональное применение нестероидных противовоспалительных препаратов (НПВП) в клинической практике» (Каратеев А.Е. и соавт., 2015), согласно которым при выборе НПВП следует учитывать риски желудочнокишечных (ЖК) и сердечно-сосудистых осложнений (табл. 15).
В последнее время появились исследования, указывающие на наличие у отдельных классов препаратов из группы НПВП иных механизмов действия, помимо ингибирования ЦОГ-1 и ЦОГ-2. Так, высокий противоболевой и противовоспалительный эффект препарата лорноксикам (относящегося к классу оксикамов) может объясняться его влиянием (помимо ингибирования ЦОГ-1 и ЦОГ-2) на центральные звенья патогенеза болевого синдрома. В недавних исследованиях было показано, что лорноксикам влияет на баланс цитокинов, а также стимулирует выработку эндогенного динорфина и эндорфина. Учитывая то, что лорноксикам сбалансированно ингибирует ЦОГ-1/ЦОГ-2, а также обладает более коротким периодом полувыведения, чем другие оксикамы, применение этого препарата приводит к снижению риска возникновения нежелательных явлений, особенно со стороны желудочно-кишечного тракта.
Таблица 15. Алгоритм назначения НПВП
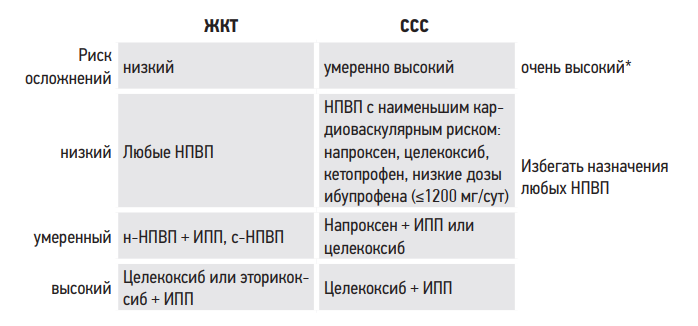
* – ИМ или ИИ/ТИА в анамнезе, ИБС, СД 2-го типа с поражением органов-мишеней, ХСН ≥ 2 NYHA.
В последнее время много говорится о многофакторном действии нимесулида. Помимо основного фармакологического действия он демонстрирует ряд эффектов, не зависимых от класс-специфического влияния на синтез ПГ, во многом определяющих его терапевтическое своеобразие. Это способность подавлять синтез провоспалительных цитокинов (интерлейкин-6, фактор некроза опухоли-α), активность металлопротеиназ (ответственных, в частности, за разрушение гликопротеинового комплекса хрящевой ткани при остеоартрозе), ингибировать синтез и высвобождение субстанции Р, оказывать антигистаминное действие. Среди «не-ЦОГ2-ассоциированных эффектов» нимесулида следует особо отметить способность подавлять фермент фосфодиэстеразу IV и тем
самым снижать активность макрофагов и нейтрофилов, играющих в патогенезе острой воспалительной реакции столь важную роль. Активация глюкокортикоидных рецепторов, ведущая к увеличению клеточной активности эндогенных глюкокортикоидов, является потенциально новым действием нимесулида, которого нет у других НПВП [Rainsford K. Nimesulide – a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin. 2006, 22(6): 1161-1170].
Дополнительный механизм действия обнаружен также у НПВП из группы диацереинов. Диацереин – относительно новый представитель медленных симптом-модифицирующих препаратов, рекомендованных для применения при суставной патологии. Он ингибирует провоспалительный цитокин IL-1b и опосредованно снижает активность IL-6 и ФНО-α. При этом диацереин не вызывает НПВП-гастропатий, т. к. не оказывает влияния на синтез ПГ, на сердечно-сосудистую систему, не вызывает гиперсенситивных реакций. Препарат обладает не только симптом-модифицирующим, но и доказанным в многочисленных исследованиях структурно-модифицирующим действием.
3. Антиконвульсанты
В клинической практике их используют в основном для лечения нейропатической боли. К болевым синдромам, которые реагируют на лечение антиконвульсантами, относятся невралгия тройничного нерва, диабетическая невропатия, таламический синдром, постгерпетическая невралгия. Кроме того, антиконвульсанты используют для превентивного лечения мигрени.
Антиконвульсанты обычно делят на два класса: препараты первого поколения и препараты второго поколения. Препараты первого поколения появились на рынке в начале ХХ в. Из-за лекарственных взаимодействий их применение может быть ограниченно, особенно в высоких дозах. В таблице 16 перечислены классы антиконвульсантов первого поколения.
Таблица 16. Aнтиконвульсанты первого поколения
| Класс | Основные препараты |
| Гидантоины | Фенитоин |
| Барбитураты | Фенобарбитал Примидон |
| Сукцинимиды | Этозуксимид |
| Прочие | Карбамазепин Вальпроевая кислота |
| Бензодиазепины | Диазепам Лоразепам Клоназепам |
Применение противосудорожных препаратов первого поколения, как правило, не рассматривается как терапия первой линии из-за связанных с их применением побочных эффектов.
Антиконвульсанты второго поколения, появившиеся в начале 1990-х гг., имеют более благоприятные фармакокинетические характеристики, профили побочных эффектов и лекарственных взаимодействий по сравнению с антиконвульсантами первого поколения (табл. 17). В целом препараты второго поколения лучше переносятся пациентами, чем антиконвульсанты первого поколения. Антиконвульсанты имеют разные, иногда перекрывающиеся механизмы действия.
Таблица 17. Aнтиконвульсанты второго поколения

Карбамазепин. Это противосудорожный препарат первого поколения, который по химическому строению близок ТЦА. Карбамазепин является препаратом первого ряда для лечения невралгии тройничного нерва. Данные о его эффективности при других типах нейропатической боли ограниченны (малое количество проведенных испытаний и небольшое число участвовавших пациентов). Карбамазепин противопоказан при таких заболеваниях и состояниях, как атриовентрикулярная сердечная блокада, подавление функции костного мозга в анамнезе, острая перемежающаяся порфирия в анамнезе, при приеме ингибиторов моноаминоксидазы.
Окскарбазепин имеет структурное сходство с карбамазепином. Было проведено несколько клинических испытаний по лечению им тригеминальной невралгии с положительным эффектом. Окскарбазепин в дозе 900–1200 мг/сут не уступает по эффективности карбамазепину, но вызывает меньше побочных эффектов. Кроме того, нет необходимости контролировать концентрацию препарата в крови и исследовать кровь на агранулоцитоз. Биодоступность окскарбазепина высока.
Габапентин. Проведено много убедительных рандомизированных плацебо-контролируемых исследований данного препарата, показавших его эффективность при нейропатической боли (в основном при постгерпетической невралгии и диабетической полиневропатии). Габапентин действует в пресинаптической части периферических сенсорных нейронов. Он связывается с добавочной субъединицей альфа-2-дельта (a2d) потенциалзависимых Ca2+ каналов, которая расположена на внеклеточной стороне канала. При этом уменьшается приток кальция внутрь клетки, что тормозит высвобождение главных медиаторов боли – глутамата и субстанции Р. При снижении концентрации или отсутствии этих нейротрансмиттеров распространение болевого импульса на следующий нейрон блокируется (рис. 21). Габапентин можно принимать независимо от приема пищи. Нет необходимости в измерении сывороточных концентраций для оптимизации лечения.
Прегабалин. Близок по механизму действия к препарату габапентин (рис. 21).
Рисунок 21. Механизм действия габапентина и прегабалина
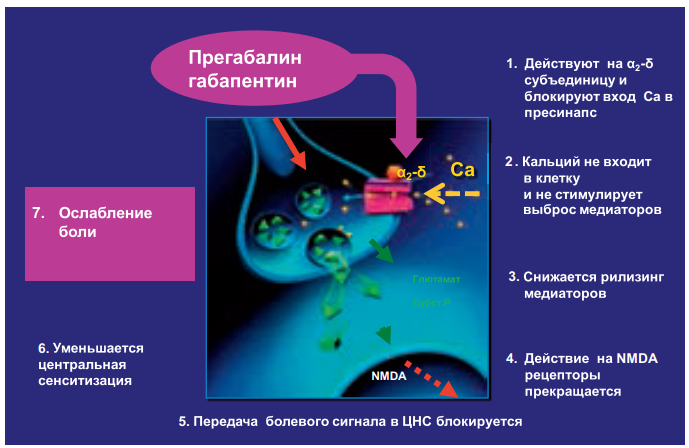
У прегабалина и габапентина схожий фармакологический профиль. Эти препараты относятся к одному классу средств, имеющих высокую аффинность к альфа-2-дельта протеину в ЦНС (их иногда называют габапентиноидами). Исследования демонстрируют, что оба препарата уменьшают высвобождение глутамата и субстанции в перевозбужденных нейронах. А поскольку выделение нейротрансмиттеров уменьшается, вероятность передачи нервного импульса на следующий нейрон становится ниже, что способствует редукции болевого синдрома. Важно отметить, что прегабалин оказывает действие только в условиях перевозбуждения, что проявляется в модуляции, приводящей к переходу в нормальное состояние. Благодаря снижению высвобождения нейротрансмиттеров прегабалин селективно подавляет возбудимость сети нейронов, причем только при патологических состояниях.
Несмотря на наличие большого сходства между прегабалином и габапентином во многих отношениях, фармакокинетический профиль препаратов имеет свои отличия. Линейность фармакокинетики прегабалина обеспечивает предсказуемость изменений концентрации данного препарата в плазме при увеличении или уменьшении вводимой дозы. Это несвойственно габапентину, характеризующемуся нелинейностью фармакокинетики (при его введении в высоких дозах отмечается уменьшение всасывания препарата в кровь). В специальных исследованиях прегабалин показал эффективность, идентичную таковой габапентина, но при существенно более низких дозировках. Вследствие этого вероятность побочных реакций у прегабалина значительно ниже, чем у габапентина. Одним из объяснений этого является тот факт, что прегабалин обладает более высокой биодоступностью (90% против 33–66% у габапентина) и более быстрой абсорбцией (пик концентрации наступает через 1 час). Кроме того, в отличие от габапентина, прегабалин имеет линейную зависимость концентрации в плазме при увеличении дозы. Это несвойственно габапентину, у которого пик концентрации отмечается через 3–4 часа, и, что более важно, зависимость концентрации при увеличении дозы препарата носит нелинейный характер.
Большое количество исследований эффективности прегабалина было проведено на моделях постгерпетической невралгии и болевой диабетической невропатии. Дозировка прегабалина – от 300 до 600 мг/ сут показала себя наиболее эффективной по сравнению с плацебо, значительно уменьшая боль и нарушения сна. Диапазон суточных доз прегабалина – 150–600 мг/сут в 2 или 3 приема. Препарат можно принимать до, во время или после еды. Выпускают капсулы 75 мг, 100 мг, 150 мг, 200 мг и 300 мг.
При лечении периферической нейропатической боли стартовая доза может составлять 150 мг/сут. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сут через 3–7 дней. При необходимости можно увеличить дозу до максимальной (600 мг/сут) через 7 дней. В соответствии с опытом применения препарата при необходимости прекращения его приема рекомендуется постепенно снижать дозу в течение недели. Прегабалин не метаболизируется в печени и не связывается с белками плазмы, поэтому он практически не взаимодействует с другими лекарствами. Прегабалин хорошо переносится. Наиболее частыми побочными реакциями являются головокружение и сонливость. Эти неблагоприятные явления аналогичны неблагоприятным явлениям, наиболее часто обнаруживаемым при лечении габапентином.
Для пациентов с болевой диабетической полиневропатией (ДПН) максимальная рекомендуемая доза прегабалина составляет 100 мг 3 раза в день (300 мг/сут). У пациентов с клиренсом креатинина ≥60 мл/мин введение препарата следует начинать с 50 мг 3 раза в день (150 мг/сут), и в зависимости от эффективности и переносимости в течение первой недели лечения доза может быть увеличена до 300 мг/сут.
Для пациентов с постгерпетической невралгией рекомендуемая доза прегабалина составляет от 75 до 150 мг 2 раза в день или от 50 до 100 мг 3 раза в день (150–300 мг/сут). У пациентов с клиренсом креатинина ≥ 60 мл/мин введение препарата следует начинать с 75 мг 2 раза в день или 50 мг 3 раза в день (150 мг/сут), и в зависимости от эффективности и переносимости в течение первой недели лечения доза может быть увеличена до 300 мг/сут.
Терапия при фибромиалгии проводится длительно – от 4 до 8 недель в суточной дозе от 300 до 600 мг.
Ламотриджин. Это антиконвульсант второго поколения с показанием к применению при эпилепсии. Он блокирует вольтаж-зависимые натриевые каналы. Проведено несколько исследований, в которых этот препарат оценивали при различных типах нейропатической боли. Эффективность доказана в нескольких исследованиях, включая лечение боли при ДПН, спинальной травме, тригеминальной невралгии, центральной постинсультной боли. В клинических испытаниях по нейропатической боли ламотриджин применяли в дозах от 200 до 400 мг/сут. Обычно лечение начинали с дозы 25 мг/сут, далее титруя ее на повышение. Побочные реакции, о которых пациенты сообщали в процессе испытаний, включали кожную сыпь, головную боль, усталость, тошноту, головокружение и бессонницу.
Топирамат имеет более сложную фармакодинамику – воздействует на ГАМК-рецепторы, блокирует каинат/АМПК-рецепторы, а также вольтажзависимые натриевые каналы. Таким образом, топирамат потенциально может снижать эктопическую активность (натриевые каналы), блокировать действие возбуждающих аминокислот при передаче импульса по синапсам в заднем роге (блокада каинат/АМПК-рецепторов) и увеличивать модуляцию болевых импульсов на сегментарном уровне в спинном мозге (ГАМК-эффект). Сообщается об эффективности топирамата при различных болевых синдромах: мигрени, кластерной головной боли, SUNCT-синдроме, фантомной боли. Эффективность топирамата в профилактическом лечении мигрени подтверждена мультицентровыми рандомизированными двойными слепыми плацебо-контролируемыми исследованиями. В качестве монотерапии и в комбинированном лечении больных мигренью топирамат уменьшает частоту цефалгических атак и интенсивность боли, количество «болевых» дней и принимаемых для купирования приступа медикаментов, снижает количество приступов с тошнотой и рвотой, улучшает качество жизни пациентов. К числу несомненных достоинств препарата относится быстрое (в течение первого месяца лечения) наступление эффекта. Дозы топирамата, применяемые в терапии мигрени, значительно ниже доз противоэпилептических препаратов. Наиболее частыми побочными эффектами являются парестезии, головная боль, слабость, головокружение, сонливость, снижение веса, тошнота, рвота, бессонница.
4. Активаторы калиевых каналов
Активатор калиевых каналов – флупиртин синтезирован в 1970-х гг. немецким фармацевтом W. von Bebenburg.
Флупиртин является прототипом нового класса веществ – селективных активаторов нейрональных калиевых каналов. Относится к неопиоидным анальгетикам центрального действия, не вызывающим зависимости и привыкания. Флупиртин обладает анальгезирующим, миорелаксирующим, нейропротективным действием и способствует предотвращению хронизации боли.
Анальгезирующее действие флупиртина обусловлено преимущественно его непрямым антагонизмом с NMDA-рецепторами. В терапевтических дозах препарат способствует открытию потенциал-независимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки (рис. 22).
Установлено, что влияние на ток ионов калия опосредовано воздействием этого лекарства на систему регуляторного G-белка, что вызывает угнетение активности NMDA-рецепторов и, как следствие, – блокаду нейрональных ионных каналов кальция, снижение внутриклеточного тока ионов кальция, угнетение возбуждения нейрона в ответ на ноцицептивные стимулы. В результате нарушается формирование ноцицептивной сенситизации (болевой чувствительности) и феномена «wind up» – увеличения нейронального ответа на повторные болевые стимулы. Это в свою очередь предотвращает усиление боли и переход ее в хроническую форму, а при уже имеющемся хроническом болевом синдроме способствует его уменьшению. Установлено также модулирующее влияние флупиртина на перцепцию боли через нисходящую норадренергическую систему.
Рисунок 22. Механизм действия флупиртина
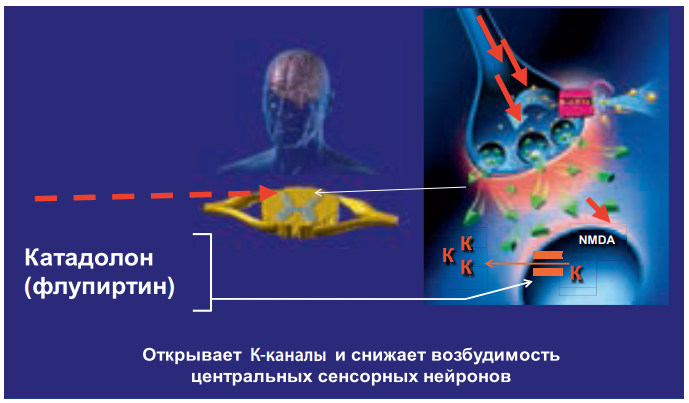
Миорелаксирующее действие флупиртина обусловлено воздействием на поперечно-полосатую мускулатуру. Этот эффект реализуется благодаря блокированию передачи возбуждения на мотонейроны и промежуточные нейроны спинного мозга. В значительной степени этот эффект может быть опосредован стимуляцией ГАМК-рецепторов. Флупиртин снимает региональный мышечный спазм, связанный с болью, при этом не влияя на общий мышечный тонус, который нормализуется без влияния на общую мышечную силу. Миорелаксирующий эффект флупиртина является ценным дополнением к анальгезирующему действию препарата, т. к. большинство болевых синдромов сопровождается мышечным спазмом.
Большой интерес представляют нейропротективные свойства флупиртина, обусловленные существованием антагонизма по отношению к NMDA-рецепторам и блокированием глутамат-кальциевого каскада, ингибированием процессов апоптоза, что было убедительно продемонстрировано в эксперименте на культуре нервной ткани. Имеются данные об использовании нейропротективного эффекта флупиртина в условиях ишемии головного мозга, его токсического поражения. Считается также, что флупиртин обладает и антиоксидантным действием.
Особенностью многих болевых синдромов является их сочетание с изменениями в эмоциональной сфере, способствующими хронизации состояния. Анальгетическое действие флупиртина основано на активации потенциал-независимых калиевых каналов, что приводит к стабилизации мембранного потенциала нервной клетки и торможению возбуждения нейрона в ответ на ноцицептивные стимулы. Сдерживание формирования центральной сенситизации и феномена «wind up» предотвращает усиление боли, переход ее в хроническую
форму, а при уже имеющемся хроническом болевом синдроме ведет к снижению его интенсивности. Результаты, полученные при использовании флупиртина в лечении ХГБН, показали высокую эффективность. После проведения курса лечения по 300 мг/сут в течение 8 недель статистически значимо снижалось количество приступов головной боли, сокращались ее продолжительность и интенсивность.
С учетом центрального спинального и супраспинального уровней воздействия флупиртина его важным достоинством является отсутствие развития привыкания или зависимости. В ходе опытов на животных (с использованием различных методов исследования) не было получено доказательств развития привыкания или зависимости даже при длительном применении препарата.
Эффективность и безопасность флупиртина в лечении боли в спине изучены в многочисленных открытых сравнительных и несравнительных исследованиях, нескольких плацебо-контролируемых исследованиях. Наибольший интерес с точки зрения доказательной медицины представляют результаты мультицентрового рандомизированного двойного слепого исследования, выполненного в Германии, посвященного изучению флупиртина (катадолона) в сравнении с миорелаксантом хлормезаноном и плацебо для лечения хронической миофасциальной боли в нижней части спины (Worz, 1996). Результаты исследования показали, что позитивно отреагировали на терапию флупиртином 60,9% испытуемых, хлормезаноном – 47,8%, а плацебо-эффект был получен у 43,8%. Эффективность флупиртина была достоверно выше, чем у плацебо (р = 0,007). Анализ безопасности лекарственных препаратов в сравниваемых группах выявил наличие нежелательных реакций у 14,8% принимавших флупиртин, у 19,3% – при приеме хлормезанона, в группе плацебо побочные эффекты отметили 7,3%. Исследователи констатировали, что флупиртин обладает адекватным профилем эффективности и безопасности у больных, страдающих хронической болью в нижней части спины.
До последнего времени на российском фармацевтическом рынке была представлена единая форма флупиртина – капсулы по 100 мг. В настоящее время появилась новая пролонгированная форма препарата – флупиртин форте. Таблетки по 400 мг обладают следующими преимуществами:
- содержат среднетерапевтическую суточную дозу флупиртина, позволяющую сократить частоту приема лекарства до 1 раза в сутки, что удобно в применении;
- обеспечивают более стабильную концентрацию препарата в течение 24-часового интервала;
- сводят к минимуму раздражающее действие лекарства на ЖКТ;
- повышают комплаентность пациентов благодаря однократному суточному приему препарата.
Наиболее очевидны преимущества пролонгированной формы флупиртина в случаях проведения длительных курсов лечения и использования высоких доз лекарства.
5. Миорелаксанты
К группе препаратов, способных уменьшить напряжение мышц, следует отнести традиционные миорелаксанты (баклофен, тизанидин, толперизон), а также флупиртин, диазепам и ботулотоксин. Термин «миорелаксанты» является не очень удачным, поскольку эти препараты не оказывают периферического действия на «напряженные мышцы» – они скорее действуют в ЦНС на разные мишени (рис. 23).
Применение миорелаксантов обосновывается признанием важной роли мышечного спазма в патогенезе боли в нижней части спины. Боль различного генеза (вследствие поражения межпозвонковых дисков, фасеточных суставов позвоночника, самих мышц и других причин) повышает активность двигательных нейронов спинного мозга, что приводит к мышечному спазму, который в свою очередь играет значительную роль в поддержании самой боли. Патологически повышенный мышечный тонус имеет различные механизмы усиления боли: непосредственное раздражение болевых рецепторов мышц, ухудшение их кровоснабжения, что приводит к образованию порочного круга, ведущего к усилению мышечного спазма и сопровождающей его боли. Миорелаксанты разрывают порочный круг «боль – мышечный спазм – боль» и вследствие этого способны ускорять выздоровление.
Рисунок 23. Препараты, уменьшающие мышечный спазм
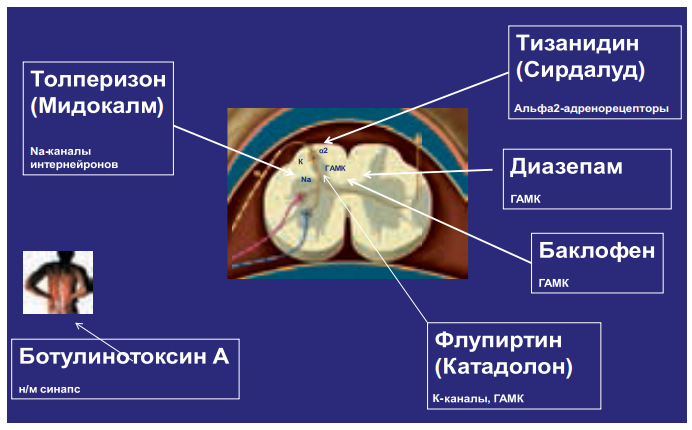
Баклофен эффективен для лечения мышечного спазма в основном за счет облегчения трансмиссии с помощью гамма-аминомасляной кислоты (ГАМК) в ЦНС. Баклофен назначают в низких дозах с последующим постепенным повышением до 50–60 мг/сут с разделением на несколько приемов. Побочные эффекты: сонливость в дневное время, головокружение, атаксия, потеря ориентации и желудочный дискомфорт. Следует отметить, что баклофен чаще используется для лечения спастичности, нежели боли, связанной с мышечным спазмом.
Тизанидин относится к миорелаксантам центрального действия (альфа-2-адренергическим агонистам) и реализует свой эффект на спинальном и супраспинальном уровне. Стимулируя пресинаптические альфа-2-рецепторы, он подавляет высвобождение возбуждающих аминокислот, которые стимулируют NMDA-рецепторы. Это приводит к подавлению передачи возбуждения через полисинаптические рефлексы спинного мозга. Препарат преимущественно угнетает полисинаптические рефлексы спинного мозга, ответственные за гипертонус мышц, что вызывает снижение повышенного тонуса сгибательной и разгибательной мускулатуры и уменьшение болезненных мышечных спазмов.
В дополнение к миорелаксирующим свойствам тизанидин оказывает также центральный умеренно выраженный анальгезирующий эффект (за счет снижения высвобождения возбуждающих нейромедиаторов в головном мозге на уровне locus ceruleus).
При легких болевых синдромах назначение тизанидина можно ограничить приемом препарата 2–4 мг на ночь до прекращения боли (обычно 5–7 дней). При умеренно выраженном болевом синдроме первый прием 2–4 мг лучше также назначить на ночь (при этом пациент «переспит» побочные эффекты), затем постепенно повысить дозу препарата до 6–8 мг/сут.
В тяжелых случаях можно добавить еще 2–4 мг тизанидина на ночь. Диапазон его эффективной суточной дозы при болевых синдромах – 2–12 мг (оптимальная доза – 6–8 мг/сут). Положительный эффект, как правило, отмечается уже на 3-й день приема препарата.
Миорелаксирующий эффект толперизона обусловлен в первую очередь мембраностабилизирующим действием на периферические нейроны, спинальные интернейроны и мотонейроны, что приводит к блокированию моно- и полисинаптических спинномозговых рефлексов. Вторично вследствие торможения поступления Ca2+ в пресинаптические окончания тормозит выделение медиаторов в синапсах, а также способствует торможению проведения возбуждения по ретикулоспинальному пути, избирательно снижает активность каудальной части ретикулярной формации головного мозга, уменьшая мышечный тонус.
Обладает слабым спазмолитическим и адреноблокирующим эффектом, усиливает периферический кровоток независимо от влияния ЦНС. Хорошо переносится пожилыми пациентами, не обладает кардиотоксическим действием, лишен седативного эффекта и не ухудшает когнитивные функции больных. Также безопасен в отношении уровня артериального давления, что особенно важно для пациентов с болевым синдромом и сопутствующими сердечно-сосудистыми заболеваниями. При купировании острой боли очень важно как можно быстрее включать в терапию физические упражнения, лечебную физкультуру и активизировать больного.
6. Витамины группы В
Интерес к широкому применению комбинации витаминов группы В при боли пришел из практики. С 1950 г. во многих странах мира их стали рассматривать как анальгетики. Хорошо известно, что витамины группы В являются нейротропными и существенным образом влияют на процессы в нервной системе. У нас в стране их применяют очень широко. Особенно популярны инъекции как отдельных витаминов (В1, В6, В12), так и их комбинаций. Клинический опыт показывает, что парентеральное использование тиамина (В1), пиридоксина (В6) и цианокобаламина (В12) хорошо купирует боль, нормализует рефлекторные реакции, устраняет нарушения чувствительности. Пример эффективной комбинации витаминов В1, В6 и В12 – препарат Нейромультивит, являющийся инъекционным комплексом с с направленным нейротропным действием в терапевтических дозировках. Нейромультивит не содержит в составе лидокаин, что снижает риск возникновения побочных эффектов, особенно со стороны сердечно-сосудистой системы. Нейромультивит производится в Австрии в соответствии с европейскими стандартами GMP и доступен широкому кругу пациентов.
Витамин В1. По данным большого метаанализа 13 рандомизированных исследований тиамина при диабетической и/или алкогольной полиневропатии (741 пациент), проведенных за 1966–2005 гг., был сделан вывод о том, что применение больших доз этого витамина может привести к кратковременному уменьшению интенсивности боли, парестезий, улучшению температурной и вибрационной чувствительности. Подчеркивается хорошая переносимость витамина В1. Авторы указывают на слабую доказательную базу и необходимость новых исследований в этом направлении. Наиболее привлекательной для терапии боли в последние годы в силу высокой биодоступности стала жирорастворимая форма витамина В1 – бенфотиамин. В двойном слепом рандомизированном исследовании бенфотиамина у больных с ДПН в течение 6 месяцев показано уменьшение болевого синдрома при отсутствии изменений со стороны других симптомов полиневропатии.
Витамин В6. Витамин В6 наиболее часто используется в лечении боли при туннельных синдромах. Из 14 исследований пиридоксина при синдроме запястного канала в 8 из них получен положительный результат, в других – либо отсутствие эффекта, либо недоказуемый эффект. Однако следует заметить, что пиридоксин в больших дозах может вызывать токсический эффект. В настоящее время для лечения синдрома запястного канала безопасной считается доза 200 мг/сут.
Витамин В12. В 2000 г. было проведено первое рандомизированное контрольное исследование внутримышечных инъекций витамина В12 при хронической боли в спине. На материале 60 больных от 18 до 65 лет показаны достоверное уменьшение боли и улучшение двигательных функций. В другом исследовании проводилось сравнение эффективности витамина В12 с антидепрессантом – нортриптилином в лечении нейропатической боли у 100 пациентов с ДПН. Было отмечено достоверное снижение боли по ВАШ на 3,66 балла в группе, получавшей инъекции витамина В12, по сравнению с группой, получавшей нортриптилин (уменьшение боли на 0,84 балла по ВАШ). Достоверно отмечалось уменьшение парестезий, ощущения жжения и зябкости.
Во многих работах подчеркивается, что лечение боли комбинациями витаминов В1, В6 и В12 более эффективно, чем монотерапия каким-либо одним из этих витаминов. Было показано, что применение витаминов В1, В6 и В12 в рекомендуемом диапазоне доз не приводит к развитию нежелательных явлений либо их выраженность незначительна.
По данным ряда клинических исследований, длительность терапии болевых вертебральных синдромов может быть уменьшена за счет применения комбинации витаминов В1, В6, В12 и диклофенака вместо проведения монотерапии диклофенаком. Кроме того, при проведении указанной комбинированной терапии может быть достигнут более выраженный анальгезирующий эффект.
В нескольких работах подчеркивается, что как использование комбинации витаминов В1, В6 и В12, так и их раздельное применение вызывает анальгезирующий эффект (рис. 24).
Рисунок 24. Возможные анальгетические механизмы витаминов группы В
7. Ботулотоксин
В последние годы накоплен богатый клинический опыт, зарегистрировано несколько препаратов ботулинического токсина типа А (БТА), проведены исследования и законодательно расширены показания к его применению. Возможности использования ботулинического токсина чрезвычайно обширны: фокальные дистонии, спастичность ДЦП, гипергидроз, коррекция мимических морщин, косоглазие. При этом благодаря многочисленным исследованиям и накоплению доказательной базы список показаний постоянно увеличивается. Одним из новых направлений применения является использование препаратов БТА в лечении болевых синдромов. История применения БТА для лечения боли началась в 1992 г., когда пластический хирург William Binder впервые обратил внимание на регресс головной боли у пациентов, которым вводился БТА c целью коррекции мимических морщин.
Основная точка приложения БТА – пресинаптические терминали холинергических синапсов, в том числе нервно-мышечных, в результате чего он вызывает дозозависимую локальную мышечную релаксацию. И хотя БТА изначально использовался для заболеваний, проявляющихся повышенным мышечным тонусом, его анальгетический эффект был отмечен уже давно. Механизм анальгетического действия БТА при болевых синдромах остается не до конца ясным.
Обсуждаются такие возможные варианты анальгетического действия:
- ослабление длительного мышечного сокращения мышц и устранение мышечных триггеров приступов боли;
- нормализация активности мышечных веретен при устранении избыточного мышечного сокращения и, как непрямое следствие, – снижение боли;
- ретроградный транспорт БТА и/или его метаболитов в ЦНС и модуляция высвобождения энкефалин-подобных веществ в стриатуме, субстанции Р, спинном мозге и ядрах шва;
- подавление высвобождения таких нейротрансмиттеров боли, как CGRP, субстанция Р, что позволяет модулировать сенсорный афферентный поток;
- подавление нейрогенного воспаления – важного фактора патогенеза болевых синдромов.
БТА используется для купирования болевого синдрома при мигрени и головной боли напряжения, цервикогенной головной боли, головной боли при краниоцервикальных формах фокальных дистоний, невралгиях, миофасциальных болевых синдромах, люмбалгии, хронической тазовой боли и др.
8. Пластырь с капсаицином
Для лечения нейропатической боли при постгерпетической невралгии недавно был предложен пластырь с 8%-ным содержанием капсаицина (КУТЕНЗА). Капсаицин – острое, жгучее действующее вещество чилийского перца или капсикума (лат. сapsicum).
Капсаицин – высокоселективный агонист TRPV1-рецепторов, представляющих собой лигандзависимые неселективные катионные каналы. Было установлено, что TRPV1-рецептор играет ключевую роль в передаче и модуляции болевых сигналов.
Эти рецепторы экспрессируются в большом количестве на сенсорных нейронах малого диаметра, дающих начало популяции ноцицептивных сенсорных нервных волокон (C-волокна и A-дельта-волокна) в периферической нервной системе и в различных областях головного мозга. TRPV1-рецепторы играют важную роль в передаче сигналов, вызванных повреждающими раздражениями (например, горячим), и передаче определенных веществ. Они сенсибилизируются медиаторами, ответственными за развитие боли в случае воспаления при повреждении тканей.
Экспрессия TRPV1 увеличивается при нейропатической боли, связанной с повреждением нервов, из-за ретроградного перемещения фактора роста нервов к телу клеток. Поскольку капсаицин – агонист TRPV1-рецепторов, предположение о его обезболивающем эффекте может показаться, на первый взгляд, нелогичным. Однако высокие дозы капсаицина при местном применении приводят сначала к возбуждению TRPV1-экспрессирующих сенсорных нейронов (возникает ощущение жара и жжения) и потом вызывают десенситизацию и даун-регуляцию (down-regulation), т. е. угнетение функции TRPV1- рецепторов. Следовательно, сенсорные аксоны небольшого диаметра становятся менее чувствительными к стимулам (в том числе к капсаицину), что приводит к уменьшению боли и аналгезии. Подобные эффекты капсаицина называют «дефункционализацией».
КУТЕНЗА представляет собой трансдермальную терапевтическую систему, содержащую 8% капсаицина. Эта система позволяет быстро доставлять действующее вещество внутрь кожи пациента, к точке его приложения, и при этом не подвергать пациента и врача нежелательному системному воздействию активного вещества.
9. Триптаны
В начале 1990-х гг. на фармацевтическом рынке появился новый класс лекарственных средств, специально разработанных для лечения мигрени, – триптаны. Они обладают высокой селективностью к серотониновым рецепторам 5НТ1D- и 5НТ1В-типов. В России клиническое применение нашли 4 препарата из группы триптанов: суматриптан, наратриптан, золмитриптан и элетриптан. Оказывая непосредственное действие на постсинаптические серотониновые 5НТ1В-рецепторы сосудистой стенки, триптаны вызывают сужение избыточно расширенных церебральных сосудов. Это снижает стимуляцию болевых рецепторов сосудистой стенки и способствует уменьшению боли. Триптаны обладают высокой селективностью в отношении кровеносных сосудов твердой мозговой оболочки и незначительной – в отношении коронарных и периферических сосудов. Триптаны ингибируют выделение альгогенных и вазоактивных белков (субстанция Р, пептид, связанный с геном кальцитонина) из периваскулярных волокон тройничного нерва и уменьшают нейрогенное воспаление. Эти препараты блокируют проведение боли на уровне спинномозгового ядра тройничного нерва. Предполагается, что центральный механизм действия обусловливает продолжительность действия 5НТ1-агонистов, способствует уменьшению рецидивов головной боли и обеспечивает эффективность препаратов в отношении сопутствующих тошноты, рвоты, свето- и звукобоязни. Нужно отметить, что суматриптан оказывает комплексное воздействие на все 3 звена мигренозного каскада: спазм патологически расширенных сосудов, блокада выходы медиаторов воспаления, снижение чувствительности окончаний тройничного нерва. Комплексное воздействие на все звенья мигренозного каскада объясняет лечебный эффект суматриптанов – устранение (снижение) мигренозной головной боли и устранение (сокращение) сопутствующей симптоматики (тошнота, рвота, звуко- и фотофобия). Суматриптан наиболее эффективен при приеме в течение первых 30 мин. от начала мигренозного приступа.
Многочисленные клинические исследования свидетельствуют об эффективности триптанов у 56–67% пациентов, что значительно превышает эффективность других средств для лечения мигрени. Их обезболивающее действие не зависит от того, через какое время после начала приступа был принят препарат, однако рекомендуется принимать их как можно раньше после начала мигренозной головной боли. Существенный эффект триптанов проявляется в течение 2–4 часов после приема первой дозы и сохраняется в течение нескольких часов. У большинства больных оптимальной дозой для купирования приступа является одна таблетка препарата (50 мг суматриптана; 2,5 мг золмитриптана; 40 мг элетриптана).
При возобновлении головной боли, но не ранее чем через 2 часа после первой дозы, возможно повторное применение суматриптана или золмитриптана. Суточная доза суматриптана должна быть не более 300 мг, золмитриптана – 15 мг. Для элетриптана эти рекомендации не подходят. Если применение 40 мг или 80 мг элетриптана не привело к уменьшению головной боли в течение 2 часов, то для купирования того же приступа не следует принимать вторую дозу, т. к. в клинических испытаниях эффективность такого лечения не доказана. Однако при повторном приступе мигрени применение элетриптана может быть эффективным. Суточная доза элетриптана не должна превышать 160 мг. У 40–60% больных триптаны эффективны в отношении сопутствующих тошноты, рвоты, свето- и звукобоязни.
10. Опиоидные анальгетики
Бесспорно, опиоиды являются самыми действенными средствами для облегчения боли благодаря агонистическому воздействию на μ-опиоидные рецепторы головного и спинного мозга. В спинном мозге, среднем мозге, стволе мозга и таламусе, а также в лимбической системе и коре головного мозга находятся рецепторы-медиаторы, на которые могут влиять эндогенные и экзогенные опиоиды. Опиоиды представляют собой гетерогенную группу препаратов, которые издавна назначаются для лечения умеренной или сильной боли. Эти средства могут быть короткого или длительного действия; они выпускаются в виде разных лекарственных форм, включая препараты для перорального (быстрого или пролонгированного действия) и внутривенного применения, а также в виде пластырей (табл. 16).
Опиоиды ценятся за их болеутоляющие свойства, но препараты этого класса вызывают в организме и другие эффекты. Опиоиды действуют на систему дыхания, сердечную деятельность, ЖКТ и мочевыводящую систему, вызывая потенциально опасные побочные эффекты. Обезболивание с помощью опиоидов также связано с проблемами толерантности к лекарственным препаратам и развития физической зависимости, а также с психологическими побочными эффектами. Выбор конкретного лекарственного препарата происходит от более слабого к более сильному средству в зависимости от клинической реакции.
Таблица 16. Опиоидные анальгетики
| Класс | Препараты |
| Агонисты опиоидных рецепторов
действуют преимущественно на μ-рецепторы |
Морфин* Меперидин* Гидроморфон Оксикодон Оксиморфон Метадон Леворфанол Фентанил Кодеин |
| Частичные агонисты опиоидных рецепторов
Вызывают эффекты только частично в μ-рецепторах |
Бупренорфин* |
| Агонисты-антагонисты опиоидных рецепторов
Вызывают эффекты в μ- и k-рецепторах Действуют как агонисты в рецепторах одного типа и как конкурентные антагонисты в рецепторах другого типа |
Буторфанол* Налбуфин* Пентазоцин |
| Антагонисты опиоидных рецепторов
Блокируют нормальные эффекты опиоидных агонистов в рецепторе Применяются для купирования побочных эффектов опиоидов, таких как угнетение дыхания и ЦНС |
Налоксон* |
*3арегистрированы в России
Очевидно, что увеличение дозы или мощности лекарства исходит из потребности контролировать боль, но это может быть связано и с устойчивостью к препарату. При боли, чувствительной к опиоидам, у пациентов обычно устанавливается плато на определенной дозе, повышать которую для контроля над болью не имеет смысла. Следовательно, если при изначальном исследовании реакции на НПВП выявляется плохой эффект, можно перейти к слабым опиоидам, например, к кодеину или трамадолу, а затем при необходимости – к сильным опиоидам, таким как морфин или оксикодон. Пластырь с фентанилом дает возможность ввести опиоид чрескожно, что вызывает меньше побочных эффектов, чем при введении других опиоидов, он удобен для пациентов и снижает вероятность злоупотребления.
В основном опиоидные анальгетики используются в лечении онкологической боли. Правила их приема и рекомендации описаны в специальной литературе. Тем не менее в случае выраженной боли опиоиды применяются и при неонкологических заболеваниях. Предложено специальное руководство по их применению. Данные метаанализов свидетельствуют о том, что в целом средства этой группы эффективны. Мнения о роли опиоидных анальгетиков в лечении нейропатической боли противоречивы. В результате недавно проведенного метаанализа были получены убедительные свидетельства эффективности этих препаратов. Среднее уменьшение интенсивности боли в исследованиях составило 20–30%. В то же время данные в отношении благоприятного воздействия на настроение, качество жизни и нетрудоспособность были противоречивыми. В этих исследованиях не было сообщено о развитии зависимости к данным средствам или наркомании. В ряде исследований была показана эффективность опиоидов в терапии нейропатической боли, причем зачастую она достигалась за счет больших доз по сравнению с болью ноцицептивной. К настоящему времени практически не существует данных о долгосрочной эффективности опиоидных анальгетиков в терапии нейропатической боли. Опубликованы результаты недавно проведенного ретроспективного анализа около 100 пациентов, получавших терапию опиоидами в течение 1 года и дольше, которые свидетельствуют о том, что применение опиоидов может обеспечивать стойкое облегчение боли. Вопрос о лечении опиоидами обычно рассматривают после безуспешных попыток купировать боль с помощью других средств. Рекомендуется применять лекарственные формы замедленного действия, лечение должно проводиться под наблюдением врача.
Отдельной проблемой при назначении наркотических анальгетиков является опасение врачей относительно развития наркотической зависимости. Однако исследования по применению опиоидов длительного действия для лечения хронической боли показали, что риск привыкания у пациентов с болью, реагирующей на опиоиды, был ниже при отсутствии таких факторов в анамнезе, как токсикомания, тяжелые расстройства личности или переживание травмирующих событий в детстве. Опасения, касающиеся угнетения дыхательной деятельности, также ограничивают применение опиоидов при хронической боли. Однако клинический опыт и исследования показывают, что боль физиологически противодействует угнетающему влиянию опиоидов на ЦНС, в то время как у наркоманов или у здоровых добровольцев, не страдающих хронической болью, этот побочный эффект был достаточно выражен. Пациентам с хронической болью можно назначать мощные наркотические средства под тщательным медицинским наблюдением без риска угнетения дыхательной деятельности.
Побочные эффекты опиоидов необходимо тщательно отслеживать (табл. 3). Часто встречаются запор, тошнота, рвота. У пациентов пожилого возраста выше риск избыточного седативного воздействия, гипотензии и задержки мочи, но при тщательном мониторинге дозы и побочных эффектов можно эффективно контролировать хроническую боль с помощью этих препаратов.
Трамадол – препарат, обладающий низкой аффинностью к опиоидным μ-рецепторам и одновременно являющийся ингибитором обратного захвата серотонина и норадреналина. В нескольких рандомизированных контролируемых исследованиях трамадол в дозе до 400 мг/сут значительно уменьшал боль и повышал социальную и физическую активность. Многие исследователи отмечают, что вероятность злоупотребления трамадолом намного ниже, чем опиоидами. Трамадол вызывает такие побочные эффекты, как головокружение, тошнота, запор, сонливость и ортостатическая гипотензия. Для снижения вероятности развития побочных эффектов и наркотической зависимости применение трамадола следует начинать с низких доз (50 мг 1 или 2 раза в день) и затем титровать каждые 3–7 дней до максимальной дозы – 100 мг 4 раза в день (для пациентов пожилого возраста максимальная суточная доза – 300 мг).
Оксикодон + налоксон в таблетках продленного действия применяется для терапии умеренной и сильной боли. При умеренной боли назначается в дозе от 5 до 20 мг/сут, при сильной боли дозы начинаются от 30–40 мг/сут.
Препарат содержит два опиоидных препарата: оксикодона гидрохлорид – агонист μ-опиоидных рецепторов и налоксон – антагонист опиоидных рецепторов. Оксикодон после приема внутрь имеет высокую абсолютную биодоступность (87%), около 45% связывается с белками плазмы, оказывает выраженное анальгетическое действие; метаболизируется в кишечнике и печени с образованием активных метаболитов при участии системы цитохрома Р450, которые выводятся почками и кишечником.
Налоксона гидрохлорид при приеме внутрь практически не всасывается (биодоступность – менее 3%), метаболизируется в печени, выводится почками. Благодаря локальному конкурентному воздействию на опиоидные рецепторы в кишечнике налоксон уменьшает выраженность нарушений функций кишечника, типичных при лечении опиоидами (тошнота, запоры). Разовые дозы препарата оксикодон + налоксон для терапии сильной боли – 10 мг / 5 мг, 20 мг / 10 мг, 40 мг / 20 мг. Пациентам, которые принимали опиоиды ранее, могут потребоваться более высокие дозы в зависимости от длительности предыдущей терапии.
11. Хондропротекторы
Интерес к этой группе препаратов как к потенциальным анальгетикам обусловлен их противовоспалительными свойствами и безопасностью применения. Хорошо изучена эффективность этих средств в лечении патологии суставов, тогда как в терапии хронической боли в спине они используются значительно реже. В специальных работах показано, что такие компоненты хондропротекторных препаратов, как глюкозамин и хондроитин, в больших дозах обладают определенными противовоспалительными эффектами и уменьшают боль независимо от структурно-модифицирующего эффекта. Отличительные особенности этих препаратов – время наступления эффекта – обычно спустя 2–8 недель от начала лечения, а также сохранение эффекта в течение 2–3 месяцев после прекращения терапии. В механизме противовоспалительного и обезболивающего действия хондроитин сульфата и глюкозамина, по-видимому, играют роль многие факторы. В частности, показано, что хондроитин сульфат влияет на клеточный компонент воспаления.
Установлено, что хондроитин сульфат дозозависимым образом подавляет стимулированный ИЛ-1 синтез коллагеназы. В экспериментальных исследованиях хондроитин сульфат в низких дозах приводил к уменьшению признаков воспаления в суставах, подавлению синтеза антител к коллагену, а в высоких (1000 мг/кг) – к подавлению деструкции хряща. Противовоспалительный и анальгетический эффекты хондроитина обусловлены влиянием на цитокины (ингибирует IL-I, IL-6, простагландины Е2, оксид азота NO). В большинстве клинических исследований, в которых сравнивался эффект хондроитин сульфата и НПВП, отмечалось, что хондроитин сульфат в дозе 1200 мг/сут так же эффективен, как большинство НПВП в терапевтических дозах, и более эффективен, чем плацебо. Глюкозамин также обладает множественными эффектами на процессы восстановления хрящевой ткани. Однако противовоспалительный и анальгетический эффекты обусловлены влиянием глюкозамина на цитокины (ингибирует IL-I, IL-6, активирует IL-10). Комбинация глюкозамин + хондроитин обладает большей анальгетической эффективностью, чем монотерапия этими препаратами. Обезболивающий эффект наступает через 2–3 недели и держится несколько месяцев.
Алфлутоп – оригинальный инъекционный препарат, представляющий собой экстракт из 4 видов мелкой морской рыбы, который содержит гликозаминогликаны, в т. ч. глюкуроновую кислоту (предшественница синтеза гиалуроновой кислоты), хондроитина-4 и -6-сульфат, дерматансульфат, кератансульфат, аминокислоты и микроэлементы. Препарат обладает хондропротективным и противовоспалительным эффектом, регулирует обмен веществ в хрящевой ткани. Его хондропротективное действие связано с угнетением активности гиалуронидазы и других ферментов, которые принимают участие в разрушении межклеточного матрикса, и одновременно Алфлутоп стимулирует биосинтез гиалуроновой кислоты, коллагена II типа и структурных протеогликанов, пролиферацию хондроцитов. Алфлутоп тормозит биосинтез медиаторов воспаления (IL-Iβ, IL-6, IL-8), его обезболивающий эффект в том числе связан с редукцией периферических ноцицептивных механизмов за счет противовоспалительного действия. Эффект терапии Алфлутопом сохряняется до 6 месяцев, поэтому лечение данным препаратом проводится курсами 2 раза в год (по 20 в/м инъекций на курс).
Для хондропротекторов Е.Л. Насонов отмечает следующие общие черты:
- их противовоспалительный эффект сравним с таковым НПВП;
- они позволяют снизить дозу НПВП;
- эффект сохраняется после окончания лечения;
- они сочетаются с парацетамолом и НПВП;
- при их применении практически отсутствуют побочные эффекты;
- они замедляют прогрессирование остеоартроза. Сравнительно новый препарат из группы хондропротекторов – пиаскледин, действующим началом которого являются неомыляющиеся соединения, полученные с помощью особой технологии из экстрактов сои и авокадо. Механизм их действия заключается в способности ингибировать ряд провоспалительных цитокинов, в частности, ИЛ-1β, ИЛ-6, ИЛ-8, металлопротеиназ (коллагеназы, стромелизина), а также увеличивать экспрессию ТФР-β1, оказывающего анаболическое влияние на суставной хрящ.
12. Мелатонин
Мелатонин представляет собой гормон шишковидного тела (эпифиза); нормализует циркадные ритмы, регулирует цикл сон – бодрствование, положительно влияет на интеллектуально-мнестические функции мозга. Способствует нормализации ночного сна (ускоряет засыпание, улучшает качество сна и самочувствие после утреннего пробуждения, не вызывает ощущения вялости, разбитости и усталости при пробуждении). Проявляет выраженные антиоксидантные свойства (один из самых сильных природных антиоксидантов). Мелатонин зарекомендовал себя как вещество с анальгетической активностью при целом ряде хронических болевых синдромов, продемонстрировав способность снижать интенсивность боли как в покое, так и при движении при добавлении к стандартной протиболевой терапии.
Известно, что анальгетический эффект мелатонина сложный и реализуется, с одной стороны, через ряд нейротрансмиттерных систем (бензодиазепиновая, опиоидная, серотонинергическая, дофаминергическая, глутаматергическая), а с другой стороны, путем взаимодействия с собственными мелатониновыми рецепторами, также было высказано предположение, что анальгетические возможности мелатонина отчасти могут быть обусловлены его способностью восстанавливать циркадные ритмы, нарушенные при хронической боли, и улучшать сон, повышать адаптивные возможности организма. Такие результаты позволяют предположить, что добавление к стандартной терапии мелатонина существенно улучшило качество жизни данных пациентов.
Учитывая вышеизложенные свойства мелатонина, получившие подтверждение и по материалам литературы, и в российских клинических наблюдениях, а также принимая во внимание его хорошую переносимость, мелатонин (Мелаксен® производства американской фармацевтической компании «Юнифарм, Инк») можно рассматривать как высокоэффективный и безопасный препарат для применения в комплексной терапии хронических болевых синдромов, особенно в случае боли исходно не очень высокой интенсивности, коморбидной с депрессивными проявлениями и нарушениями сна у пациента. Препарат Мелаксен® – точный синтетический аналог человеческого мелатонина. Его получают из аминокислот растительного происхождения, что повышает безопасность препарата. Он обладает всеми теми свойствами, что и естественный мелатонин, в том числе способностью регулировать биологические ритмы, нормализовать сон и снижать интенсивность болевых симптомов. Мелаксен® на территории РФ является оригинальным лекарственным препаратом, содержащим 3 мг мелатонина.