Боль. Биологические, психологические и социальные аспекты боли
Содержание страницы
1. Типы и патофизиологические механизмы боли
Боль воспринимается посредством специализированной сенсорной системы – ноцицептивной. Цель этой системы – обеспечение безопасности организма. В ходе эволюции ноцицептивная система обучилась идентифицировать некоторые стимулы (экстремальную температуру, механическое или химическое повреждение тканей) как угрожающие целостности организма. Информация об их воздействии воспринимается как сильное и неприятное ощущение – боль. Как следствие, человек незамедлительно реагирует: отдергивает руку от горячего предмета, останавливает нож, коснувшийся кончика пальца, защищается в случае удара. Таково адаптивное значение ноцицептивной системы – она помогает выживать. Однако зачастую боль приобретает патологическое значение. Боль, являющаяся следствием нарушений в работе нервной системы, становится дезадаптивной. Именно с этой болью часто приходится сталкиваться врачу. В настоящее время идет активное изучение механизмов ее возникновения на разных биологических уровнях. Исследуются изменения в работе нервных синапсов, генетического аппарата клеток, а также структурные перестройки в нервной системе. Понимание механизмов формирования патологической боли позволяет разрабатывать методы лечения.
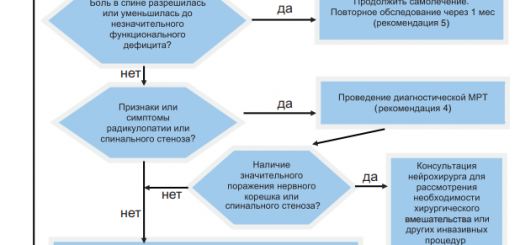
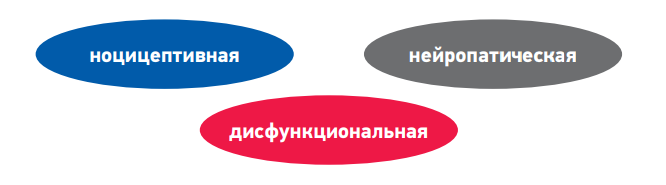
В настоящее время классификация боли не устоялась. Исходя из различий в анатомии и патофизиологии большинством авторов предложено рассматривать три типа боли (рис. 1).
Основная идея идентификации типов боли заключается в том, чтобы затем определить возможные патофизиологические механизмы (рис. 2) и подобрать лекарственные препараты, способные целенаправленно влиять на эти механизмы боли.
Рисунок 1. Tипы боли
Ноцицептивной называют боль, возникающую в ответ на раздражение болевых рецепторов (ноцицепторов) тепловыми, холодовыми, механическими, химическими стимулами или воспалением (рис. 3).
В большинстве случаев ноцицептивная боль является адаптивной защитной реакцией – она способствует выживанию особи. При состоявшемся повреждении тканей возникает воспалительная реакция, одним из следствий которой является воспалительная боль. Макрофаги, тучные клетки и нейтрофилы выделяют многочисленные медиаторы воспаления. Те воздействуют на ноцицепторы и повышают их чувствительность. На этом фоне даже небольшое механическое, температурное или химическое раздражение воспринимается как болевой сигнал.
Рисунок 2. Патофизиологические механизмы боли
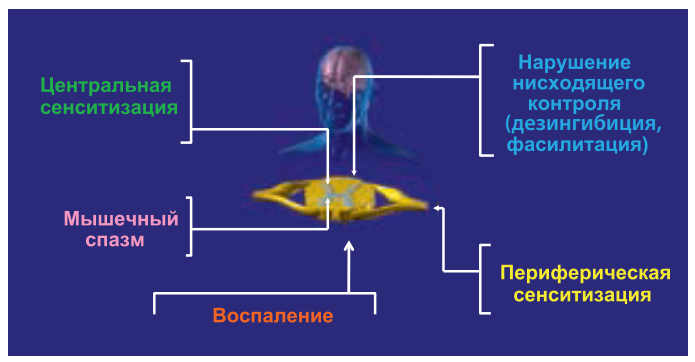
Рисунок 3. Hоцицептивная боль
Цель воспалительной боли – не допустить дополнительной травматизации тканей и таким образом обеспечить оптимальные условия для их заживления. Однако в случаях патологического воспаления (например, при ревматоидном артрите) адаптивное значение боли утрачивается. Хотя воспалительная боль является вариантом ноцицептивного типа боли, некоторые авторы выделяют ее как самостоятельную форму. На наш взгляд, удобнее рассматривать ее как вариант ноцицептивной боли, т. к. и при механическом, термическом или химическом воздействии на ноцицепторы есть те или иные элементы воспаления.
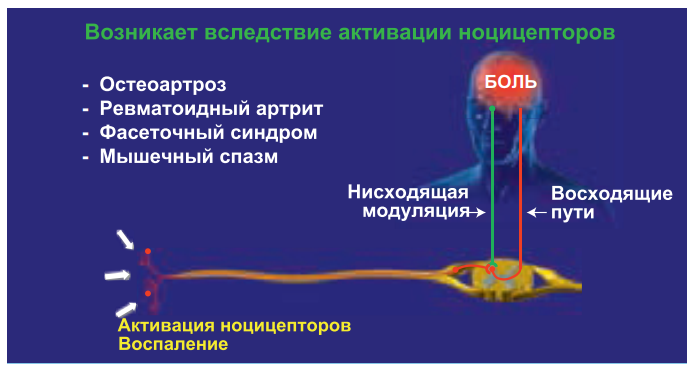
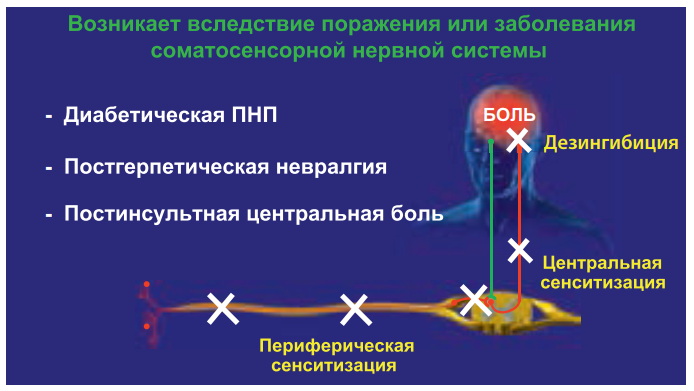
Нейропатическая боль возникает при повреждении или органическом заболевании периферических либо центральных звеньев соматосенсорной нервной системы: при травме нерва, диабетической полинейропатии, постгерпетической невралгии, травме спинного мозга, последствиях инсульта, рассеянном склерозе и др. Нейропатическая боль в отличие от ноцицептивной и воспалительной не является сигналом о повреждении тканей и не имеет защитной функции. Ее причина – возникновение патологических изменений в самой нервной системе на разных уровнях (рис. 4).
Рисунок 4. Hейропатическая боль
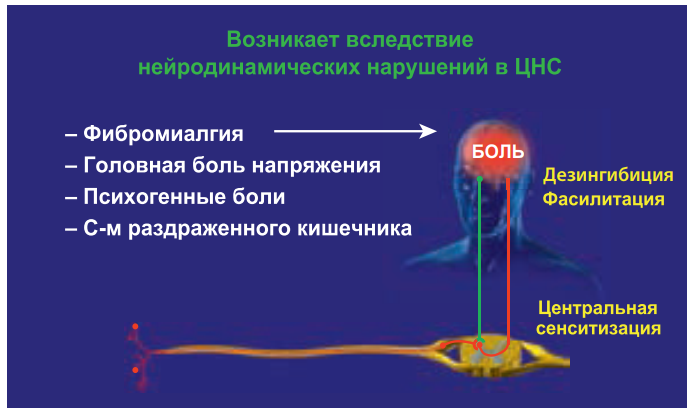
Еще один вид патологической боли – боль дисфункциональная, возникающая при отсутствии активации ноцицепторов и видимого органического повреждения, в том числе со стороны нервной системы. Суть патогенеза заключается в том, что эта боль обусловлена изменением функционального состояния в первую очередь церебральных систем, участвующих в контроле боли. Эти нарушения в литературе принято называть «нарушением обработки сенсорной информации» или «синдромом центрального усиления боли».
Главное отличие дисфункциональной боли от ноцицептивной и нейропатической заключается в том, что при традиционном обследовании не удается выявить причину боли или органические заболевания, которые могли бы объяснить происхождение боли. Основными факторами, способствующими развитию этого типа боли, являются не органические заболевания или повреждения, а психологические, социальные факторы и эмоциональный стресс. Именно они играют ключевую роль в нарушении адекватной работы нисходящих норадренергической и серотонинергической систем. В конечном итоге это приводит к тому, что обычные, неболевые стимулы начинают восприниматься как болевые.
К типичным примерам такой боли относятся фибромиалгия, головная боль напряжения и психогенная боль (соматоформные расстройства) (рис. 5). В патогенезе этих заболеваний именно психосоциальные факторы являются главными. Наряду с этим следует отметить, что функциональные изменения в работе церебральных антиноцицептивных систем (дисфункциональный компонент) развиваются при синдроме раздраженного кишечника, интерстициальном цистите, вульводинии, хронической тазовой боли. Это имеет чрезвычайно важное значение для понимания данной патологии и проведения терапии, направленной на различные звенья патогенеза: как на периферические, так и на центральные. Кроме того, в специальных исследованиях продемонстрировано, что дисфункциональный компонент боли (в частности, недостаточность нисходящей ингибиции и центральная сенситизация) может развиваться у части больных при длительно персистирующих периферических болевых синдромах. Например, при остеоартрозе у 10–15% больных в клиническую картину включаются аллодиния, вторичная гипералгезия, что указывает на развитие центральной сенситизации и других функциональных изменений в ЦНС. В этих случаях к терапии нестероидными противовоспалительными препаратами (НПВП) рекомендуют добавить антидепрессанты двойного действия (дулоксетин, венлафаксин) или препарат прегабалин, действующие на центральные механизмы боли.
Рисунок 5. Дисфункциональная боль
Следует заметить, что сам термин «дисфункциональная боль» является довольно спорным, поскольку по мере совершенствования методов исследования нервной системы граница между «функциональным» и «органическим» становится все призрачнее. Как и любой патологический процесс в организме, дисфункциональная боль имеет биологическую основу (дизрегуляция нейромедиаторных систем, изменения синаптической передачи и др.). Однако делать упор в объяснении ее механизмов и лечении на биологические факторы будет крайне неэффективным. При дисфункциональной боли решающее значение имеют психосоциальные факторы.
Традиционным для выбора лекарства от боли является оценка ее интенсивности. Однако идентификация типа боли и понимание патофизиологических механизмов являются важными для определения подходов к терапии и выбору фармакологических препаратов. Этот подход, который в литературе обозначается как «механизм-обусловленная терапия боли», основан на том, что фармакологические препараты обладают различными свойствами воздействия на разные механизмы боли. Уточнив тип боли и его механизм(ы), можно добиться более целенаправленной и дифференцированной фармакотерапии.
2. Периферические и центральные механизмы боли
Традиционно рассматриваются две основные теории болевого восприятия. Согласно первой, выдвинутой М. Frey, в коже имеются болевые рецепторы, от которых начинаются специфические афферентные пути к мозгу. Было показано, что при раздражении кожи человека через металлические электроды, прикосновение которых даже не ощущалось, выявлялись «точки», пороговая стимуляция которых воспринималась как резкая нестерпимая боль. Вторая теория, предложенная Goldscheider, постулирует, что любой сенсорный стимул, достигающий определенной интенсивности, может вызвать боль. Другими словами, не существует специфических болевых структур, а боль является результатом суммации термических, механических и других сенсорных импульсов. Названная вначале «теорией интенсивности», позже эта теория стала более известна как теория «паттерна» или «суммации». Однако исследования последних лет, посвященные изучению анатомии и физиологии боли, в большой степени «примирили» эти две оппозиционные научные теории.
С точки зрения периферических механизмов боли, действительно показана большая степень их специфичности, однако она не является абсолютной, как полагал M. Frey. В настоящее время установлено, что существуют два типа периферических дистальных сенсорных нейронов, наиболее активно реагирующих на ноцицептивные стимулы. Первый тип – это очень тонкие немиелинизированные С-волокна (0,4–1,1 мкм в диаметре), второй – тонкие миелинизированные А-дельта-волокна (1,0–5,0 мкм в диаметре).
Согласно современным данным периферические рецепторы этих нейронов в большом количестве содержатся в различных тканях и органах и имеют множество концевых разветвлений с мелкими аксоплазматическими отростками, которые и являются структурами, активируемыми болевым воздействием. На основании изучения ответных характеристик этих тонких афферентов были выделены три их вида: механосенситивные, термосенситивные и полимодальные ноцицепторы. Первые два активируются только интенсивным повреждающим ткань давлением или термической стимуляцией; их эффекты опосредуются как А-дельта-, так и С-волокнами. Полимодальные афференты являются немиелинизированными, реагируют на механические и термические стимулы. А-дельта-волокна отвечают как на легкое прикосновение, давление, так и на болевые стимулы. Их активность соответствует интенсивности стимула. Эти волокна проводят также информацию о характере и локализации болевого стимула. Наблюдения о гетерогенности А-дельта- и С-волокон могут объяснить, например, появление отличных от боли ощущений при раздражении роговицы, в которой локализуются исключительно свободные нервные окончания указанных выше нейронов.
С активацией афферентных волокон определенного калибра связывают различные типы болевых ощущений: так называемую первичную – коротколатентную, хорошо локализованную и качественно детерминированную боль, и вторичную – длиннолатентную, плохо локализованную, тягостную, тупую боль. Экспериментально было показано, что «первичная» боль связана с афферентной импульсацией в А-дельта-волокнах, а «вторичная» – с С-волокнами. Однако А-дельта- и С-волокна не являются исключительно проводниками болевой чувствительности, они активируются также неповреждающими термическими (тепловыми, холодовыми) и механическими (прикосновение, небольшое сдавление) стимулами.
Ядра периферических афферентов расположены в спинномозговых ганглиях, откуда центральные аксоны направляются через задние корешки в задний рог спинного мозга (краниальные афференты заканчиваются, соответственно, в ядре тройничного нерва, аналоге заднего рога спинного мозга). Тонкие миелинизированные и немиелинизированные волокна при входе в спинной мозг занимают латеральную позицию, а в самом спинном мозге тонкие волокна формируют отдельный пучок, именуемый трактом Лиссауэра, который отвечает за афферентацию боли. Было показано, что пересечение этого тракта у животных приводит к полной сегментарной аналгезии. Однако у человека этот тракт содержит также и проприоспинальные волокна, и строго дифференцировать или выделить с помощью селективной ризотомии отдельные пучки «болевых» и «неболевых» нервных волокон практически не удается.
Тонкие миелинизированные и немиелинизированные волокна, проходя через тракт Лиссауэра, заканчиваются в поверхностных отделах заднего рога. Многие из этих волокон заканчиваются ипсилатерально в аналогичных зонах соседних выше- и нижележащих спинальных сегментов, а часть из них, пройдя через переднюю спайку, заканчивается в контралатеральном заднем роге. Цитоархитектонические исследования показали, что нейроны заднего рога организованы в девять слоев или пластин. Тонкие миелинизированные волокна (А-дельта) оканчиваются главным образом в I пластине, а также в III и частично в V пластинах по Rexed. Немиелинизированные С-волокна заканчиваются во II пластине (желатинозной субстанции). От этих клеток начинаются вторые нейроны, контактирующие с клетками боковых и передних рогов тех же и соседних спинальных сегментов, обеспечивая реализацию вегетативных и соматических рефлексов. Другие вторые нейроны, участвующие в проведении боли, проецируются контралатерально (лишь незначительная их часть идет ипсилатерально) и затем направляются к верхним уровням.
Среди образований заднего рога особое место занимает желатинозная субстанция. Практически все исследователи придают ей большое значение как нейрональной системе, регулирующей сенсорный вход и болевую чувствительность на сегментарном уровне. Однако существуют различные представления о механизмах этой регуляции. Желатинозной субстанции отводится ключевая роль в одной из самых распространенных теорий боли – теории «входных ворот» или теории «воротного контроля боли» (Melzak R., Wall P.D., 1965).
Согласно этой теории формирование ноцицептивного потока на сегментарном уровне происходит в результате взаимодействия быстропроводящей, хорошо миелинизированной и медленнопроводящих безмиелиновой систем на релейных нейронах спинного мозга. Суть теории заключается в том, что активность толстых миелиновых волокон приводит к возбуждению нейронов желатинозной субстанции, которые оказывают ингибирующее влияние на релейные нейроны, тем самым контролируя прохождение на более высокие уровни ноцицептивной импульсации со стороны тонких немиелинизированных волокон.
В последние годы было получено много данных о трансмиссии боли на уровне заднего рога. Показано, что терминали тонких афферентов в заднем роге содержат нейропептиды (в частности, субстанцию Р, холецистокинин, соматостатин, глютамат). Стимуляция А-дельта-волокон сопровождается выбросом глютамата и субстанции Р, приводящей к активации нейронов заднего рога. Химическая деструкция у животных афферентных терминалей, содержащих субстанцию Р, вызывает аналгезию. Показано, что опиаты снижают содержание субстанции Р. Опиатные рецепторы найдены как на пресинаптических терминалях аксонов, так и на постсинаптических дендритах. Нейроны II пластины заднего рога обладают способностью вырабатывать энкефалины, ингибирующие нейротрансмиттеры. Глютамат действует на NMDA рецепторы постсинаптической мембраны вторых сенсорных нейронов, играя существенную роль в формировании феномена центральной сенситизации.
Существуют две «классические» – лемнисковые и экстралемнисковые восходящие афферентные системы. Главную роль в передаче ноцицептивной информации играют экстралемнисковые пути, расположенные в боковых столбах спинного мозга. Источниками этих проекций являются нейроны I–V пластин заднего рога. Их аксоны переходят через переднюю спайку и образуют на другой стороне афферентный путь к церебральным структурам. Восходящая афферентная система условно разделяется на два основных тракта: спиноталамический (или неоспиноталамический) и спиноретикулоталамический (или палеоспиноталамический). Неоспиноталамический путь состоит из быстропроводящих волокон и несет чувствительную, распознающую боль информацию в зрительный бугор, заканчиваясь в вентральных постериолатеральных и частично в интраламинарных его ядрах. Этот путь обеспечивает передачу сенсорной информации в конкретные зоны сенсорной коры и реализует сенсорно-дискриминативные аспекты боли, т. е. информацию о ее локализации, идентификации и интенсивности.
Филогенетически более древний спиноретикулоталамический тракт состоит из медленнопроводящих волокон, отдает диффузные проекции в ретикулярную формацию ствола, околоводопроводное вещество, ядра шва, гипоталамус, лимбическую систему, лобные доли и таламус и играет основополагающую роль в формировании аффективных, мотивационных и поведенческих характеристик боли. Аналогичным образом построена система проведения импульсации из ядра спинномозгового пути тройничного нерва, которая включает в себя неотригеминоталамический и палеотригеминоталамический пути.
В соответствии с положением, учитывающим возможности проведения болевых импульсов по многим другим восходящим системам, предложено сгруппировать пути болевой афферентации в две системы: латеральную (неоспиноталамический, неотригеминоталамический, заднестолбовой, спиноцервикальный путь) и медиальную (палеоспиноталамическая, палеотригеминоталамическая, мультисинаптическая проприоспинальная восходящая система).
Изучение механизмов боли не только является важным для понимания ее патофизиологии, но и позволяет определить стратегию лечения. В настоящее время выбор лекарственных препаратов и немедикаментозных методов терапии боли во многом зависит не от ее локализации и интенсивности, а от патофизиологических механизмов ее формирования. На протяжении многих десятков лет глубоко изучались периферические механизмы боли (роль ноцицепторов, возбудимость периферических сенсорных нейронов, воспаление и др.). Однако за последние 30 лет произошли существенные изменения в представлениях о роли центральной нервной системы (ЦНС) в патогенезе болевых синдромов, что открыло новые перспективы для лечения. Одним из важнейших механизмов формирования хронической боли является феномен центральной сенситизации (ЦС). Он был описан C. Woolf в 1983 г. ЦС характеризуется тем, что после прекращения воздействия серии периферических болевых стимулов остается определенный уровень возбуждения в центральных сенсорных нейронах заднего рога, и это состояние сохраняется в течение некоторого времени автономно или поддерживается очень низким уровнем ноцицептивной стимуляции. Это приводит к тому, что поступление в задний рог спинного мозга слабых болевых или неболевых стимулов воспринимается как боль. Аллодиния (появление боли в ответ на неболевой раздражитель) и вторичная гипералгезия – характерные клинические проявления ЦС. Это явление отличается от феномена «wind-up», который представляет собой постепенное возрастание потенциала действия при стимуляции серией идентичных стимулов. Совсем недавно стало ясно, что в дополнение к потенциалзависимой синаптической пластичности изменения в микроглии, астроцитах, мембранной возбудимости и транскрипции генов могут способствовать сохранению ЦС.
Важным следствием этих ранних фундаментальных научных исследований стала вероятность того, что боль, которую мы испытываем, не обязательно является отражением воздействия периферических болевых стимулов. Мы знаем из нашего повседневного опыта, что боль появляется в ответ на периферическое повреждение, и это имеет решающее значение для защитной функции. ЦС представляет другой аспект, при котором ЦНС может существенно влиять на боль: изменить ее характеристики, исказить, повысить степень интенсивности, продолжительность и пространственную протяженность. Таким образом, не столько специфические качества непосредственно воздействующих периферических болевых стимулов влияют на формирование боли, сколько функциональное состояние ЦНС.
С открытием механизма ЦС концептуально изменилось представление о том, что боль всегда является результатом периферического повреждения и вызванной этим афферентной ноцицептивной активности. В этом смысле ЦС представляет собой разобщение четкой взаимосвязи между стимулом и ответом, которая определяет формирование ноцицептивной боли. Она отражает восприятие болевых стимулов на периферии. При их отсутствии ноцицептивной боли нет. Однако после открытия феномена ЦС стало ясно, что боль может возникнуть и без периферического болевого стимула. Если активность сенсорных нейронов в ЦНС увеличилась, то они могут начать активироваться поступлением неболевых стимулов. В результате в этих условиях боль может стать абсолютно реальной при отсутствии ноцицептивных стимулов. Такая боль не может называться ноцицептивной, она скорее является индуцированной и сопровождается гиперчувствительностью, аллодинией и вторичной гипералгезией. Эти болевые проявления встречаются во многих клинических ситуациях, что закономерно ставит вопрос: какой вклад вносит ЦС в формирование клинической боли? То, что боль может быть результатом изменений в ЦНС и «реальным» нейробиологическим явлением, которое вносит свой вклад в формирование боли, многим кажется маловероятным. Появление боли при отсутствии очевидных периферических повреждений многими врачами рассматривается как психическое расстройство – симуляция или истерия. Некоторые врачи в ситуациях, когда не могут найти органическую причину боли, предпочитают использовать такие диагностические ярлыки, как психосоматические и соматоформные расстройства. В настоящее время, спустя почти 30 лет после открытия ЦС, благодаря многочисленным исследованиям на здоровых добровольцах и на пациентах мы знаем гораздо больше об этом феномене и можем оценить его вклад в формирование различных болевых синдромов.
Какие клинические характеристики боли возникают вследствие развития ЦС? Экспериментальные исследования показывают, что если пациент имеет динамическую тактильную аллодинию, вторичную точечную, вызванную давлением гипералгезию, временную суммацию и сенсорное последействие, вполне вероятно, что имеет место ЦС. Любая сенсорная реакция, более значительная по амплитуде, продолжительности или пространственной протяженности, чем можно было ожидать от определенной периферической стимуляции в нормальных условиях, потенциально расценивается как центральное влияние: увеличение возбуждения или снижение торможения. Однако поскольку мы не можем непосредственно измерить сенсорную стимуляцию, а также потому, что периферические изменения сами могут способствовать поддержанию ЦС, само наличие боли и гиперчувствительности недостаточно, чтобы неопровержимо говорить о ЦС. Следующая сложность заключается в том, что уменьшение боли после местной анестезии не исключает ЦС, поскольку периферический стимул обычно является для нее триггером. Этот факт может лишь указывать на роль периферической стимуляции в поддержании ЦС. Тем не менее есть некоторые особенности симптомов пациента, которые, скорее всего, указывают на центральный, а не периферический механизм в возникновении боли и гиперчувствительности. К ним относятся тактильная аллодиния, распространение болевой чувствительности в местах, где нет очевидной патологии (вторичная гипералгезия), сенсорное последействие, увеличение временной суммации и сохранение боли при воздействии низкочастотных стимулов, которые обычно не вызывают боли.
Чтобы оценить, как ЦС может быть представлена у пациентов, мы должны детализировать фенотипы различных когорт пациентов с болью, чтобы наиболее точно охарактеризовать все изменения чувствительности и отобразить, где и когда они возникают. В идеале это должно быть объединено с объективными показателями, такими, как данные магнитно-резонансной томографии (МРТ), электронейромиографии (ЭНМГ) и др. Таким образом можно точно установить четкие диагностические критерии для определения ЦС у пациентов.
Практическое значение диагностических критериев для определения ЦС заключается в том, что это не только дает представление о патофизиологических механизмах, ответственных за возникновение боли, но и в большей степени позволяет определить потенциальную стратегию лечения. Если боль конкретного пациента является ноцицептивной, при которой главный механизм – активация болевых рецепторов вследствие воспаления, тогда оптимальными для терапии будут НПВП. Однако если у пациента присутствуют аллодиния и вторичная гипералгезия, обусловленные ЦС в результате изменений синаптической
активности в спинном мозге, тогда лучше использовать лекарственные средства, целенаправленно действующие на ЦС. Этими свойствами обладают такие препараты, как прегабалин, габапентин, трициклические антидепрессанты (ТЦА) (амитриптилин), ингибиторы обратного захвата серотонина и норадреналина (дулоксетин, велафаксин, милнаципран). Такой подход к выбору фармакологических препаратов получил название «механизм-обоснованная терапия боли».
3. Психологические факторы и боль
С введением теории воротного контроля боли Мельзака (Melzack) и Уолла (Wall) в 1965 г. ученое сообщество признало роль центральных (психологических) факторов восприятия боли. В результате во многих исследованиях делались попытки выделить психологические характеристики, присущие пациентам с хронической болью. Например, для описания этих психологических характеристик широко применялся Миннесотский многопрофильный личностный опросник (MMPI). В ранних работах пытались дифференцировать «функциональную» боль от «органической». Однако большинство исследователей ставят под сомнение пользу и правомерность такого разделения хронической боли. Хроническая боль – это сложная психофизиологическая модель поведения, в которой невозможно выделить отдельные психологические и физические компоненты.
Биопсихосоциальная модель боли, которая включает физические, психологические и социальные элементы, отходит от слишком упрощенного понимания боли, характерного для биомедицинской модели заболевания, и заменяет его альтернативной многомерной концепцией. В этой модели психологические факторы рассматриваются как элемент сложного процесса восприятия боли. По мере того, как боль приобретает хронический характер, психологические составляющие все более выходят на первый план в поддержании болезненного поведения и страданий (Turk, St. Monarch).
В этой главе мы обсудим одну из важных проблем, к решению которой должны быть готовы клиницисты, имея дело с пациентами с хронической болью, – это психологические нарушения и боль.
Есть основания предполагать, что у больных с хронической болью, в отличие от пациентов с острой болью, развиваются специфические психологические проблемы, связанные с отсутствием облегчения боли. Например, в 1973 г. ученые Штернбах (Sternbach), Вулф (Wolf), Мёрфи (Murphy) и Акесон (Akeson) сравнивали профили MMPI группы пациентов с острой болью в области поясницы (продолжительность боли – менее 6 месяцев) с профилями больных с хронической болью той же локализации (продолжительность боли – более 6 месяцев).
Результаты показали значительную разницу между двумя группами по первым трем клиническим шкалам: ипохондрии, депрессии и истерии. Комбинированная оценка этих трех шкал иногда называется невротической триадой, поскольку часто обнаруживается у больных неврозами, которые испытывают тревогу и страх (другой типичной распространенной моделью является конверсия, когда шкалы 1 и 3 оцениваются выше, чем шкала 2). Эти результаты указывают на то, что на ранних стадиях боль не приводит к большим психологическим проблемам. Однако если она приобретает хронический характер, возникают психологические изменения, которые, скорее всего, связаны с постоянным дискомфортом, безысходностью и чрезмерным вниманием к боли, что становится доминантой в жизни этих пациентов, так же как и их неспособность решать обычные семейные, профессиональные и связанные с досугом задачи. Это может привести к наслоению поведенческих, психологических проблем на исходную ноцицепцию и переживание боли.
В исследованиях с участием пациентов с хронической болью в области поясницы, проходивших интенсивный курс 3-недельной программы реабилитации, обнаружены аналогичные результаты (Barnes, Gatchel, Mayer & Barnett, 1990). В этом исследовании больные заполняли опросник MMPI до и после проведения программы реабилитации. Результаты показали, что по первым трем клиническим шкалам до начала программы лечения у этих пациентов было существенное повышение количества баллов. Однако после 6 месяцев наблюдения в результате успешного завершения этой программы, которая оказалась хорошей реабилитацией и позволила большинству пациентов вернуться к работе, показатели по этим трем шкалам снизились до нормального уровня. Таким образом, эти результаты еще раз указывают на то, что повышение количества баллов связано с травмой и стрессом при хронической боли. При успешном лечении эти клинически значимые изменения уменьшаются.
В чем же значение приведенных выше данных, касающихся взаимосвязи между психологическими расстройствами и хронической болью? Не может быть никакого сомнения, что психологические особенности важны не только для восприятия боли, но и для последующего развития связанной с ней нетрудоспособности. Здесь клиницисты должны уделять внимание психологическим характеристикам своих больных. Многие пациенты, которые позднее становятся хроническими, могут изначально обладать некоторыми преморбидными или предрасполагающими психологическими и личностными характеристиками, которые усиливаются из-за эмоционального стресса, вызванного попыткой адаптации к боли. Следовательно, раннее вмешательство необходимо для более эффективного ведения этих пациентов. Значительную роль в процессе хронификации боли играют социоэкономические и ситуационные составляющие, например, такая вторичная выгода, как компенсация за утрату трудоспособности. У таких предрасположенных пациентов большая вероятность превратиться в хронических больных, плохо поддающихся лечению. Наконец, это не означает, что данные предрасполагающие факторы позволяют трактовать хроническую боль как «функциональное» расстройство и считать, что все это происходит «у пациента в голове». Проблемы хронической боли представляют собой сложное взаимодействие между физическими и психосоциоэкономическими переменными.
Как только боль принимает хронический характер, психологические особенности начинают играть доминирующую роль в поддержании болевого поведения и страданий. Согласно представленной концептуальной модели перехода острой боли в хроническую, предполагается, что тип психологического дистресса, наблюдаемого у пациентов с подострой или хронической болью, зависит от преморбидных или существовавших ранее личностных психологических характеристик данного индивидуума. Психопатология – это одна из основных психосоциальных составляющих или источников дистресса, с которыми сталкиваются клиницисты в работе с больными с хронической болью. К наиболее часто диагностируемым категориям относятся следующие расстройства: депрессивное, тревожное, соматоформное, аддиктивное и расстройство личности. Хотя между болью и каждым конкретным типом психопатологии существуют свои уникальные аспекты взаимодействия, модель «предиспозиция – стресс» является доминирующей всеобъемлющей теоретической концепцией. В этой модели в качестве предиспозиции выступают уже существовавшие до возникновения хронической боли неявные характеристики личности, которые затем активировались под воздействием стресса, связанного с этим хроническим состоянием, и выразились, возможно, в виде диагностируемой психопатологии. Клиницистам необходимо оценивать наличие психопатологии независимо от ее типа, чтобы эффективно с ней справляться в процессе курса реабилитации.
Депрессия и боль. Депрессия в значительной степени влияет на характеристики болевого синдрома, поведение больного, качество жизни и прогноз заболевания. При наличии депрессии боль имеет большую интенсивность. Депрессивное состояние обусловливает специфическое болевое поведение пациента с хронической болью и приводит к существенному ограничению выбора стратегий преодоления боли, из которых наиболее часто встречается катастрофизация. В результате пациенты начинают воспринимать боль как состояние, угрожающее их здоровью или даже жизни, и становятся еще более депрессивными. В конечном итоге снижается самооценка, пациенты теряют веру в возможность эффективного решения болевой проблемы и надежду на излечение. Будущее им кажется мрачным и безнадежным. У больных, страдающих хроническими болевыми синдромами и депрессией, как правило, нарушается социальная и профессиональная адаптация, а качество жизни оказывается существенно сниженным. Частый спутник депрессии – гнев или агрессия. Чем больше хроническая боль ограничивает жизненную активность и нарушает качество жизни пациента, тем более раздражительным и озлобленным он становится. Депрессия формирует у больного состояние беспомощности и полной зависимости от болевого синдрома. Между болью и депрессией образуется своеобразный порочный круг, при котором одно состояние усугубляет другое.
Тревога и боль. Во многих исследованиях отмечена высокая распространенность тревожных расстройств у пациентов с хронической болью. К тревожным расстройствам относятся следующие: паническое расстройство, агорафобия, специфическая фобия, социофобия, посттравматическое стрессовое расстройство, обсессивно-компульсивное расстройство и генерализованное тревожное расстройство. Хотя в научной литературе, посвященной хронической боли, существуют некоторые противоречия в отношении специфических тревожных расстройств, паническое тревожное расстройство и генерализованное тревожное расстройство диагностируются наиболее часто. В исследованиях с использованием структурированного клинического интервью общая распространенность тревожных расстройств при хронической боли составляет 16,5–28,8% (Asmundson et al., 1996). Хотя общая распространенность близка к таковой среди населения, тревожные расстройства чаще ассоциируются с хронической болью, чем об этом сообщалось в научной литературе. Наконец, в исследованиях, где проводилось разделение между тревожными расстройствами в анамнезе и в настоящее время (например, Burton et al., 1997; Polatin et al., 1993), обнаружено, что распространенность в анамнезе близка к таковой для населения в целом, в то время как распространенность в настоящее время значительно выше у пациентов с хронической болью.
Больные с хронической болью в целом чаще подвержены психопатологии, чем пациенты с острой болью. Страх расценивается как обычная реакция на острую боль, а нетрудоспособность и различные виды психопатологии ассоциируются с хронической болью. Модель «предрасположенность – стресс», описанная ранее в разделе о депрессии, также применима к взаимосвязи между хронической болью и тревожными расстройствами. В 1993 г. Polatin et al. обнаружили, что у 95% пациентов с нетрудоспособностью в связи с хронической болью в области поясницы с диагностированным тревожным расстройством данное расстройство наблюдалось и до начала хронической боли. Это позволяет предположить существование физиологического или психологического преморбидного состояния, которое в дальнейшем усиливалось под действием стресса от переживания хронической боли. Если реакция в виде тревожности существует, хроническая боль может поддерживаться и усиливаться посредством прямых физиологических механизмов (Flor & Turk, 1989). Страх боли и страх движения или повторного повреждения ведут к дальнейшей физической дезадаптации в результате уклонения от физической активности, что потенциально надолго снижает боль и может также способствовать поддержанию боли. Уклонение от физической активности в свою очередь может усиливаться оперантными механизмами научения. Например, возможно уклонение от нежелательной ответственности, или же страх связан с ожиданием того, что в дальнейшем связанные с болью переживания нельзя будет уменьшить. Результатом является порочный круг между познанием и поведением.
Обнаружено, что представления о работе как об избегании ситуации, связанной со страхом боли, являются наиболее специфичными и мощными факторами, объясняющими нетрудоспособность и потерю работы в связи с болью в области поясницы. Один дополнительный когнитивный фактор может оказаться важным для поддержания хронической боли: это тенденция чувствительных к страху пациентов неверно интерпретировать ощущение волнения, возбуждения, придавая ему катастрофичность, и воспринимать его как боль.
Психологические установки и боль. Многочисленные работы указывают на большое значение такого психологического фактора, как установка. Вопрос о роли психологических установок остается недостаточно освещенным, особенно в отечественной литературе. Существующие в настоящее время, преимущественно за рубежом, работы по данной проблеме подчеркивают необходимость изучения установок. В публикациях все чаще появляются указания на то, что психологические установки пациентов оказывают влияние на хронизацию болевого синдрома, а во многих случаях являются решающими факторами, определяющими в конечном итоге прогноз заболевания. Впервые явление установки было открыто немецким психологом Л. Ланге в 1888 г. в экспериментальной психологии при изучении ошибок восприятия. В настоящее время нет общепринятого определения установки. Зарубежные авторы определяют установки (англ. set) как личностно-сформированные или распространенные в определенной культуре когнитивные образования. В советское время проблемой установки занимался грузинский психолог Д.Н. Узнадзе, который дал следующее определение установки: «Установка субъекта – это неосознаваемая и обусловленная прошлым опытом детерминирующая тенденция, внутреннее состояние готовности человека определенным образом воспринимать, оценивать и действовать по отношению к явлениям и объектам действительности». Таким образом, установка – это неосознанная готовность к поведению или действию. Среди установок выделяют две группы: адаптивные установки, при которых больной охотно и точно выполняет все указания врача, придерживается положительного отношения к медицине вообще и к доктору, который его лечит, в частности, и дезадаптивные установки, напротив, имеющие характер предубеждения.
Установки, связанные с болью (болевые установки), – это представления человека о том, что такое боль и что она значит для него. Так, у одних пациентов имеются представления, что выраженность боли обязательно должна соответствовать степени повреждения, поэтому они, подчиняясь болевым ощущениям, максимально ограничивают физическую активность, увеличивая тем самым инвалидизацию (дезадаптивные установки). Другие больные, даже имея значительные структурные нарушения, воспринимают боль как неопасную и не подчиняют ей свою активность (адаптивные установки). Считается, что дезадаптивные болевые установки являются одним из основных факторов риска перехода острой боли в хроническую.
Большинство исследований по изучению установок при хронической боли касаются боли при ревматоидном артрите, фибромиалгии, остеоартрозе и боли в спине. Исследований установок при хронической головной боли напряжения (ХГБН) до последнего времени не проводилось. Нами проведено исследование влияния психологических установок на течение и прогноз ХГБН (Данилов А.Б., Подымова И.Г., 2011). Исследование включало две группы пациентов. Основную группу составили 40 женщин с диагнозом ХГБН (МКГБ-II, 2003), в возрасте от 20 до 60 лет, с длительностью заболевания не менее 6 месяцев. В группу сравнения вошли 20 женщин с эпизодической головной болью напряжения (ЭГБН), сопоставимых по возрасту. Полученный в настоящем исследовании более высокий уровень дезадаптивных установок при ХГБН по сравнению с ЭГБН может свидетельствовать об их участии в формировании и/или поддержании ХГБН. Наибольшие различия между группами получены по шкале «Необъяснимость боли» опросника «Болевые установки». Последнее может указывать на то, что восприятие боли как необъяснимой, т. е. отсутствие понимания причины испытываемой головной боли, чаще ведет к ее хронизации. В данной работе мы также оценивали катастрофизацию пациентами своей боли. Катастрофизация определяется как крайне преувеличенное негативное представление пациента о собственном состоянии. Катастрофизация, как и установки, относится к когнитивной составляющей боли. Оценка этого феномена представляется нам важной, т. к. именно катастрофизация определяет степень адаптации пациента к боли. В нашей работе уровень катастрофизации в группе ХГБН оказался достоверно выше, чем в группе ЭГБН. Это может свидетельствовать о том, что более высокий уровень катастрофизации при ХГБН усугубляет клиническое течение заболевания, следовательно, ухудшает прогноз.
Психологические установки представляют собой относительно неизменные представления людей о природе вещей. Наше исследование подтвердило это положение и в отношении установок при головной боли напряжения. Полученное в настоящей работе отсутствие достоверных различий в уровнях установок и катастрофизации до и после лечения говорит о том, что они являются достаточно ригидными когнитивными образованиями, трудно поддающимися изменениям. При сравнении групп с «эффективным» и «неэффективным» лечением было показано, что в группе с «неэффективным» лечением имелась изначальная высокая установка на «стабильность боли», т. е. настрой на то, что боль со временем не уйдет. Это позволяет предположить, что высокие дезадаптивные установки могут снижать эффективность лечения. Проведенное исследование подтверждает многочисленные данные о важной роли психологических и социокультурных факторов в эффективности лечения у пациентов с хронической болью. Дезадаптивные установки больных при ХГБН являются одним из главных факторов низкой эффективности проводимой терапии.
В связи с этим своевременное выявление дезадаптивных установок и их успешная коррекция позволят добиться лучших результатов при лечении хронической боли.
4. Социальные факторы и боль
Поведенческие реакции, возникающие у человека в период острой или хронической боли, объединяются термином «болевое поведение», которое включает в себя вербальные и невербальные реакции (Turk D.C., 1983; Haythornthwaite J.A. et al., 1991). Болевое поведение индивидуума не только зависит от характера и интенсивности боли, но и в значительной степени определяется особенностями его личности и внешними факторами, например, реакцией окружающих людей. Болевое поведение можно разделить на следующие категории:
- вербальная реакция на боль в виде сообщения о травме, стонов, вздохов и выражения боли с указанием ее субъективной выраженности;
- невербальное двигательное болевое поведение, например, прихрамывание, использование трости или повязки, гримасы боли, защита и поглаживание больного места;
- общий уровень двигательной активности, сидячее или лежачее положение;
- прием лекарственных препаратов и использование медицинских приспособлений для контроля над болью.
Общепринятое определение качества всех видов болевого поведения – это их способность воспроизводиться при соответствующем повреждении ткани или раздражении (Sanders, 1985).
Адаптивное, или «хорошее», болевое поведение – это, как правило, просто противоположность болевым реакциям. Это поведение можно разделить на те же самые четыре категории, что и болевое поведение. К нему относятся вербальное сообщение о снижении уровня боли, улыбка, сокращение использования лекарственных препаратов и других средств для контроля над болью, большая двигательная активность, стремление работать, а также участие в социальной жизни и развлечениях. В формировании болевого поведения играют роль механизмы социального и оперантного научения.
Согласно концепции социального научения поведение при боли (открытое выражение боли, стресс и страдание) может усваиваться в процессе научения путем наблюдения и моделирования. Люди могут научиться новым поведенческим реакциям, наблюдая за другими людьми, которые реагируют именно так. Люди, испытывающие боль, привлекают к себе внимание. Существует большое количество экспериментальных доказательств того, что физиологические реакции на болевые раздражители могут быть обусловлены просто наблюдением за людьми, испытывающими боль. Показано, что дети, чьи родители страдают хронической болью, выбирают связанные с болью реакции на предложенные им сценарии. Более того, учителя считают, что дети, родители которых страдают хронической болью, чаще демонстрируют болезненное поведение (например, жалобы, пропуск занятий и визиты к школьной медсестре), чем дети здоровых родителей. Дети усваивают отношение к боли, к медицинской помощи, к восприятию и интерпретации симптомов, определенную реакцию на травму и болезнь от своих родителей на основании культурных стереотипов и социальной среды. На основании своего опыта дети вырабатывают образ действий, который позволяет им избежать боли и научиться «подходящему» (приемлемому) способу реагирования. В течение дня у детей случается множество мелких травм. То, как взрослые рассматривают эти переживания, предоставляет достаточно возможностей для научения. Научение у детей влияет на то, будут они игнорировать симптомы или реагировать на них, и если да, то в какой степени.
Доказано, что в семье, где один из супругов проявляет излишнюю заботу, вероятность возникновения у второго супруга болевых жалоб значимо выше, чем в обычных семьях (Flor H. et al., 1987). Та же закономерность прослеживается в отношении гиперопеки над детьми со стороны родителей. Специальный опрос пациентов с хроническими болевыми синдромами показал, что их ближайшие родственники часто страдали от мучительной боли. В таких «болевых семьях» в нескольких поколениях может формироваться специфическая модель реагирования на боль. Показано также, что чем ниже культурный и интеллектуальный уровень пациента, тем выше вероятность развития у него психогенных болевых синдромов и соматоформных расстройств. Оперантное научение – это обучение животных и человека определенной модели поведения на основе спонтанного порождения организмом множества разнообразных реакций в ответ на один и тот же стимул или ситуацию с последующим закреплением только тех реакций, которые оказались наиболее удачными с точки зрения полученного эффекта.
Модель оперантного научения утверждает, что на все формы внешнего поведения в значительной мере влияют его последствия и окружающая обстановка, в которой это поведение реализуется. В этой модели фундаментальным понятием является «подкрепление», механизм которого заключается в том, что, демонстрируя свою боль врачу или окружающим людям, пациент получает сочувствие и поддержку с их стороны. В этом случае он как бы использует болевое поведение для достижения определенных целей: избежать нежелательной деятельности и выполнения нежелательных обязанностей, получить льготы, более легкую работу или инвалидность. Чем больше внимания и поддержки получает больной от окружающих, тем чаще он использует болевое поведение в своих целях, что в конечном итоге приводит к закреплению и персистированию болевой проблемы. Кроме того, такие проявления болевого поведения, как ограничение физической активности, вынужденная поза, потребность в посторонней помощи и др. сами по себе ограничивают активность и адаптацию пациента и надолго выключают его из нормальной жизни.
Оперантный подход предполагает, что положительное подкрепление болевого поведения может способствовать формированию хронической боли. Болевое поведение может получить прямое положительное подкрепление вследствие избыточного внимания супруга или медицинского работника. В исследованиях было показано, что страдающие болью больные отмечали различные уровни болевых ощущений в экспериментальной ситуации в зависимости от того, знали они о том, что за ними наблюдают супруги либо медицинские работники, или нет. Пациенты, имевшие незаботливых супругов, чаще жаловались на боль нейтральным наблюдателям, чем супругам, и наоборот. В то же время больные с заботливыми супругами сообщали о более выраженной боли в присутствии супругов, чем в присутствии нейтрально настроенного медицинского работника.
Болевое поведение может получить прямое положительное подкрепление также путем применения лекарственных препаратов или отказом от нежелательной деятельности, например, от работы. При этом «хорошее поведение» (например, физическая активность и работа) не получает достаточного положительного подкрепления и угасает. Но болевое поведение (особенно бездеятельность) можно подавить, а «хорошее поведение» (физическую активность) – стимулировать с помощью вербального подкрепления и назначения комплекса упражнений.
Как правило, степень болевого поведения коррелирует с субъективной оценкой интенсивности боли: чем выше интенсивность боли, тем ярче выражено болевое поведение. Значительное влияние на характер болевого поведения у пациентов с хроническими болевыми синдромами оказывают когнитивные факторы, такие как отношение к своей болезни, готовность к «борьбе», надежда на исцеление или, напротив, отсутствие веры в излечение. Всеобъемлющие социокультурные факторы и факторы окружающей среды (например, политический и экономический курс, медицинское обслуживание по месту жительства, культурные обычаи и религиозные обряды) также влияют на болевое поведение и обладают достаточно мощным регулирующим действием. На основании концепции оперантного научения разработаны подходы к лечению, направленные на искоренение болевого поведения и замену его адаптивным поведением путем положительного подкрепления.
Биологически обусловленные различия между мужчинами и женщинами определяют особенности реакции на ноцицепцию. Кроме того, на восприятие боли влияют гендерные особенности – психологические и социокультурные свойства мужчин и женщин. Эпидемиология, проявления и прогноз болевых синдромов могут варьироваться в зависимости от биологического пола и гендера. Очевидно, что эти различия следует учитывать при назначении лечения.
5. Боль и сон
В новом формируемом направлении «Медицина сна» важное место занимают болевые синдромы. В проведенных исследованиях показано, что каждый третий пациент испытывает ночную боль, приводящую к нарушениям сна (инсомнии). При этом каждую ночь эти пациенты теряют по 2,4 ч нормального сна, или в среднем 8,5 ночи в месяц. Отмечено, что при дефиците сна более 20 ч (т. е. около трех полных ночей) в месяц отмечается достоверное снижение качества жизни, включая физическое здоровье, настроение, способность выполнять работу. Среди пациентов, имеющих ночную боль, 79% говорили, что боль мешает заснуть, 65% просыпаются из-за боли, в 65% случаев больные просыпаются раньше обычного. Следует отметить, что 92% пациентов, испытывающих ночную боль, страдают и от дневной боли. Почти половина (49%) пациентов с ночной болью отмечают, что им значительно труднее работать, «не хватает энергии». Половина опрошенных пациентов никогда не обращались к врачам по поводу существующей боли, но большинство из них принимали те или иные обезболивающие медикаменты. Наиболее популярными препаратами, которыми пользовались пациенты для снятия боли, были парацетамол, НПВП и аспирин. В ряде случаев больные пользовались немедикаментозными способами: техникой релаксации (5%), горячими ваннами (5%), изменением положения тела (4%).
Ночью доминируют боль в спине (64%) и головная боль (56%). Миалгии и другие типы боли встречаются в 55% случаев. Часто имеет место сочетание боли различной локализации. Женщины чаще, чем мужчины, испытывают ночную боль (соответственно 58% и 48%). Причем отмечено, что эти женщины достоверно чаще, чем мужчины, сообщают о стрессовых ситуациях дома (соответственно 61% и 49%). Среди типов ночной боли у женщин преобладает головная боль (соответственно 60% и 49%), у мужчин чаще отмечается мышечная боль (соответственно 62% и 49%). Пациенты с ночной болью старше 50 лет теряют больше часов нормального сна (10 ночей в месяц) по сравнению с больными моложе 50 лет (6 ночей в месяц). После 50 лет доминирующими являются артралгии (старше 50 лет – 60%, моложе 50 лет – 20%).
Таким образом, боль, появляющаяся или усиливающаяся в ночное время, нарушая нормальный ночной сон, – более существенный фактор дезадаптации, чем «дневная» боль, и в большей степени боль влияет на снижение качества жизни. В работах последних лет показано, что нарушения ночного сна оказывают существенное негативное влияние на работу церебральных антиноцицептивных систем, что является важным фактором патогенеза хронической боли.
Все это определяет важность и необходимость оценки болевого синдрома в цикле сон – бодрствование, адекватного подбора лекарственных препаратов, а также коррекции поведения больного. При выборе лекарственных препаратов при нарушениях сна у пациентов с болевыми синдромами важно учитывать механизмы их влияния на боль и сон.
Существенным является представление о том, что коррекция нарушений сна заключается не только в улучшении процесса засыпания и увеличении продолжительности непрерывного сна, но и в регуляции и восстановлении биологических ритмов в цикле сон – бодрствование. В этом плане перспективным средством является мелатонин. Опубликованные исследования указывают на эффективность и безопасность применения мелатонина при таких болевых синдромах, как мигрень, кластерная головная боль, фибромиалгия, синдром раздраженного кишечника. Так, в исследовании на базе Первого Московского государственного медицинского университета им. И.М. Сеченова приняли участие 178 пациентов в возрасте от 40 до 65 лет с хронической неспецифической болью в нижней части спины при длительности боли более 3 месяцев и интенсивностью более 3 баллов по визуальной аналоговой шкале (ВАШ). Пациенты были разделены на 6 групп, которые составили 3 пары сравнения (основная и контрольная группы). В 1-й паре больные обеих групп получали комбинированный препарат глюкозамина гидрохлорид 500 мг и хондроитина сульфат 500 мг. Во 2-й паре – комбинированный препарат глюкозамина гидрохлорид 500 мг и хондроитина сульфат 500 мг и диклофенак. В 3-й паре – диклофенак. Дополнительно все пациенты основных групп получали мелатонин (Мелаксен, «Юнифарм, Инк»). Длительность наблюдения в 1-й паре составила 3 месяца, во 2-й и 3-й – 1 месяц. Среди пациентов основных групп были выделены две подгруппы – респондеры и нон-респондеры в зависимости от откликаемости на терапию мелатонином. Изучались исходные факторы, предопределяющие эффективность терапии мелатонином. В результате исследования были получены данные, демонстрирующие во всех основных группах статистически достоверное более значительное снижение интенсивности боли при движении и в покое, чем в группах сравнения, что свидетельствует о возможных анальгетических свойствах мелатонина. Кроме того, выделены факторы, предопределяющие эффективность такой терапии. Добавление мелатонина (Мелаксен, «Юнифарм, Инк») к стандартной схеме лечения боли в спине повышает ее эффективность, особенно в случае коморбидности боли с нарушением сна и депрессивными проявлениями.
Полагают, что антиноцицептивный эффект мелатонина обусловлен его действием на мелатониновые рецепторы в таламусе, гипоталамусе, задних рогах спинного мозга, ядрах тройничного нерва. Активация непосредственно мелатониновых рецепторов MT1 и MT2 приводит к снижению синтеза аденозинмонофосфата и редукции ноцицепции. Кроме того, показано, что мелатонин опосредованно может активировать нисходящую опиоидную систему, обладает свойствами ингибировать фермент ЦОГ-2 и способен блокировать продукцию провоспалительных цитокинов.
Также специалистами подчеркивается необходимость использования нелекарственных подходов для улучшения качества сна. При этом очень важно соблюдение гигиены сна, которая предусматривает необходимость ложиться спать и вставать в одно и то же время, исключить дневной сон (особенно во второй половине дня), не употреблять на ночь чай или кофе, уменьшить стрессовые ситуации, умственную нагрузку (особенно в вечернее время), организовать физическую нагрузку в вечернее время (но не позднее, чем за 3 ч до сна) и регулярно использовать водные процедуры перед сном.
В работах последних лет показано, что расстройства ночного сна существенно нарушают работу церебральных антиноцицептивных систем, что является важным фактором патогенеза хронической боли. Все это определяет важность и необходимость оценки болевого синдрома в цикле сон – бодрствование, коррекции поведения пациента и адекватного подбора лекарственных препаратов с учетом продолжительности их действия, времени назначения, влияния на механизмы боли и сна.